Mô hình nguyên tử của Đặc điểm Bohr, Định đề, Hạn chế
các Mô hình nguyên tử của Bohr là một đại diện của nguyên tử được đề xuất bởi nhà vật lý người Đan Mạch Neils Bohr (1885-1962). Mô hình nói rằng electron di chuyển trên quỹ đạo ở một khoảng cách cố định xung quanh hạt nhân nguyên tử, mô tả một chuyển động tròn đều. Các quỹ đạo - hay mức năng lượng, như ông gọi chúng - có năng lượng khác nhau.
Mỗi khi electron thay đổi quỹ đạo, nó sẽ phát ra hoặc hấp thụ năng lượng với số lượng cố định gọi là "lượng tử". Bohr giải thích quang phổ ánh sáng phát ra (hoặc bị hấp thụ) bởi nguyên tử hydro. Khi một electron di chuyển từ quỹ đạo này sang quỹ đạo khác về phía hạt nhân, có sự mất năng lượng và ánh sáng được phát ra, với các đặc tính bước sóng và năng lượng.

Bohr đánh số các mức năng lượng của electron, xem xét rằng electron càng gần hạt nhân thì trạng thái năng lượng của nó càng thấp. Theo cách này, electron càng ở xa hạt nhân, số mức năng lượng sẽ càng cao và do đó trạng thái năng lượng sẽ cao hơn.
Chỉ số
- 1 Đặc điểm chính
- 1.1 Nó dựa trên các mô hình và lý thuyết khác của thời đại
- 1.2 Bằng chứng thực nghiệm
- 1.3 Electron tồn tại ở mức năng lượng
- 1.4 Không có năng lượng thì không có chuyển động của electron
- 1.5 Số electron trong mỗi lớp
- 1.6 Electron quay theo quỹ đạo tròn mà không cần năng lượng bức xạ
- 1.7 quỹ đạo được phép
- 1.8 Năng lượng phát ra hoặc hấp thụ trong các bước nhảy
- 2 định đề của mô hình nguyên tử Bohr
- 2.1 Định đề đầu tiên
- 2.2 Định đề thứ hai
- 2.3 Định đề thứ ba
- 3 Sơ đồ mức năng lượng cho các nguyên tử hydro
- 4 3 hạn chế chính của mô hình Bohr
- 5 điều quan tâm
- 6 tài liệu tham khảo
Đặc điểm chính
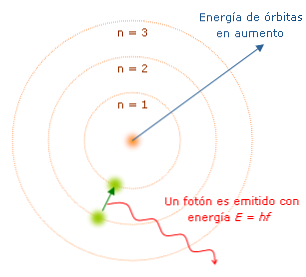
Các đặc điểm của mô hình Bohr rất quan trọng vì chúng xác định con đường hướng tới sự phát triển của một mô hình nguyên tử hoàn chỉnh hơn. Những cái chính là:
Nó dựa trên các mô hình và lý thuyết khác của thời đại
Mô hình của Bohr là người đầu tiên kết hợp lý thuyết lượng tử được hỗ trợ bởi mô hình nguyên tử của Rutherford và những ý tưởng lấy từ hiệu ứng quang điện của Albert Einstein. Thật ra Einstein và Bohr là bạn.
Bằng chứng thực nghiệm
Theo mô hình này, các nguyên tử chỉ hấp thụ hoặc phát ra bức xạ khi các electron nhảy giữa các quỹ đạo được phép. Các nhà vật lý người Đức James Franck và Gustav Hertz đã thu được bằng chứng thực nghiệm về các trạng thái này vào năm 1914.
Electron tồn tại ở mức năng lượng
Các electron bao quanh hạt nhân và tồn tại ở các mức năng lượng nhất định, chúng rời rạc và được mô tả bằng số lượng tử.
Giá trị năng lượng của các mức này tồn tại dưới dạng hàm của số n, được gọi là số lượng tử chính, có thể được tính bằng các phương trình sẽ được trình bày chi tiết sau.
Không có năng lượng thì không có chuyển động của electron
Hình minh họa trên cho thấy một điện tử làm cho nhảy lượng tử.
Theo mô hình này, không có năng lượng thì không có sự chuyển động của electron từ cấp này sang cấp khác, cũng như không có năng lượng, không thể nâng một vật rơi xuống hoặc tách hai nam châm.
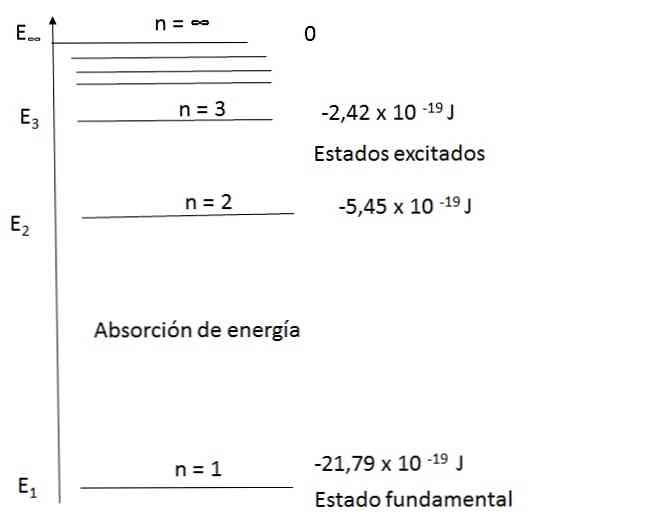
Bohr đề nghị lượng tử là năng lượng cần thiết của một electron để truyền từ cấp này sang cấp khác. Ông cũng tuyên bố rằng mức năng lượng thấp nhất mà electron chiếm được gọi là "trạng thái cơ bản". "Trạng thái kích thích" là trạng thái không ổn định hơn, xuất phát từ sự chuyển điện tử sang quỹ đạo năng lượng cao hơn.
Số electron trong mỗi lớp
Các electron phù hợp trong mỗi lớp được tính bằng 2n2
Các nguyên tố hóa học là một phần của bảng tuần hoàn và trong cùng một cột có cùng các electron ở lớp cuối cùng. Số lượng elecrones trong bốn lớp đầu tiên sẽ là 2, 8, 18 và 32.
Các electron quay theo quỹ đạo tròn mà không cần năng lượng bức xạ
Theo Định đề thứ nhất của Bohr, các electron mô tả các quỹ đạo tròn xung quanh hạt nhân của nguyên tử mà không phát ra năng lượng.
Quỹ đạo được phép
Theo Định đề thứ hai của Bohr, các quỹ đạo được phép duy nhất cho một electron là những quỹ đạo mà động lượng góc L của electron là bội số nguyên của hằng số Planck. Về mặt toán học, nó được thể hiện như thế này:
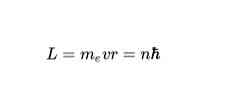
Năng lượng phát ra hoặc hấp thụ trong các bước nhảy
Theo Định đề thứ ba, các electron sẽ phát ra hoặc hấp thụ năng lượng trong các bước nhảy từ quỹ đạo này sang quỹ đạo khác. Khi nhảy lên quỹ đạo, một photon được phát ra hoặc hấp thụ, năng lượng của nó được biểu diễn dưới dạng toán học:
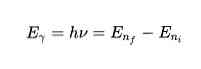
Các định đề của mô hình nguyên tử Bohr
Bohr đã liên tục cho mô hình hành tinh của nguyên tử, theo đó các electron xoay quanh hạt nhân mang điện tích dương, cũng như các hành tinh quanh Mặt trời.
Tuy nhiên, mô hình này thách thức một trong những định đề của vật lý cổ điển. Theo đó, một hạt có điện tích (như electron) di chuyển theo đường tròn, sẽ mất năng lượng liên tục do phát xạ bức xạ điện từ. Khi mất năng lượng, electron sẽ phải theo một vòng xoắn ốc cho đến khi rơi vào hạt nhân.
Bohr sau đó cho rằng các định luật vật lý cổ điển không phù hợp nhất để mô tả sự ổn định quan sát được trong các nguyên tử và ông đã trình bày ba định đề sau:
Định đề đầu tiên
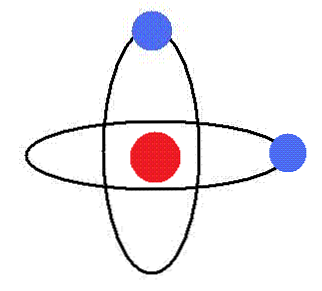
Các electron quay xung quanh hạt nhân trong các quỹ đạo quay tròn, mà không phát ra năng lượng. Trong các quỹ đạo này, động lượng góc quỹ đạo là không đổi.
Đối với các electron của nguyên tử, chỉ cho phép các quỹ đạo của bán kính nhất định, tương ứng với các mức năng lượng xác định nhất định.
Định đề thứ hai
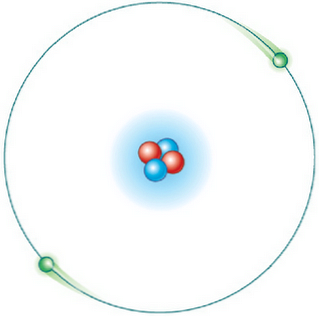
Không phải tất cả các quỹ đạo đều có thể. Nhưng một khi electron ở trong quỹ đạo được phép, nó ở trạng thái năng lượng cụ thể và không đổi và không phát ra năng lượng (quỹ đạo năng lượng đứng yên).
Ví dụ, trong nguyên tử hydro, năng lượng cho phép của electron được cho theo phương trình sau:
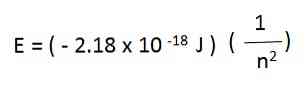
Năng lượng electron của một nguyên tử hydro được tạo ra từ phương trình trên là âm đối với mỗi giá trị của n. Khi n tăng, năng lượng ít âm hơn và do đó, tăng.
Khi n đủ lớn - ví dụ, n = - năng lượng bằng 0 và biểu thị rằng electron đã được giải phóng và nguyên tử ion hóa. Trạng thái không năng lượng này chứa năng lượng lớn hơn trạng thái có năng lượng âm.
Định đề thứ ba
Một electron có thể thay đổi từ quỹ đạo năng lượng đứng yên sang quỹ đạo khác bằng cách phát ra hoặc hấp thụ năng lượng.
Năng lượng phát ra hoặc hấp thụ sẽ bằng với chênh lệch năng lượng giữa hai trạng thái. Năng lượng E này ở dạng photon và được cho theo phương trình sau:
E = h ν
Trong phương trình này E là năng lượng (được hấp thụ hoặc phát ra), h là hằng số Planck (giá trị của nó là 6,63 x 10-34 joule-giây [J-s]) và ν là tần số ánh sáng, có đơn vị là 1 / s.
Sơ đồ mức năng lượng cho các nguyên tử hydro
Mô hình Bohr đã có thể giải thích thỏa đáng quang phổ của nguyên tử hydro. Ví dụ, trong phạm vi bước sóng của ánh sáng khả kiến, phổ phát xạ của nguyên tử hydro như sau:
Chúng ta hãy xem làm thế nào bạn có thể tính toán tần số của một số dải ánh sáng quan sát được; ví dụ màu đỏ.
Sử dụng phương trình đầu tiên và thay thế n cho 2 và 3, bạn sẽ nhận được kết quả xuất hiện trong sơ đồ.

Đó là:
Với n = 2, E2 = -5,45 x 10-19 J
Với n = 3, E3 = -2,42 x 10-19 J
Sau đó có thể tính chênh lệch năng lượng cho hai cấp độ:
ΔE = E3 - E2 = (-2,42 - (- 5,45)) x 10 - 19 = 3,43 x 10 - 19 J
Theo phương trình giải thích trong định đề thứ ba ΔE = h ν. Sau đó, bạn có thể tính ν (tần số ánh sáng):
ν = ΔE / h
Đó là:
= = 3,43 x 10-19 J / 6,63 x 10-34 J-s
= = 4,56 x 1014 s-1 hoặc 4,56 x 1014 Hz
Là λ = c / ν và tốc độ ánh sáng c = 3 x 10 8 m / s, bước sóng được cho bởi:
λ = 6,565 x 10 - 7 m (656,5nm)
Đây là giá trị bước sóng của dải màu đỏ quan sát được trong phổ của các vạch hydro.
3 hạn chế chính của mô hình Bohr
1- Nó thích nghi với quang phổ của nguyên tử hydro nhưng không phải là quang phổ của các nguyên tử khác.
2- Các tính chất không điều hòa của electron không được biểu diễn trong phần mô tả này như là một hạt nhỏ xoay quanh hạt nhân nguyên tử.
3- Bohr không giải thích được tại sao điện từ cổ điển không áp dụng cho mô hình của mình. Đó là lý do tại sao các electron không phát ra bức xạ điện từ khi chúng ở trong quỹ đạo đứng yên.
Bài viết quan tâm
Mô hình nguyên tử của Schrödinger.
Mô hình nguyên tử của Broglie.
Mô hình nguyên tử của Chadwick.
Mô hình nguyên tử của Heisenberg.
Mô hình nguyên tử của Perrin.
Mô hình nguyên tử của Thomson.
Mô hình nguyên tử của Dalton.
Mô hình nguyên tử của Dirac Jordan.
Mô hình nguyên tử của Democritus.
Tài liệu tham khảo
- Nâu, T. L. (2008). Hóa học: khoa học trung tâm. Thượng Yên River, NJ: Pearson Prentice Hall
- Eisberg, R., & Resnick, R. (2009). Vật lý lượng tử của các nguyên tử, phân tử, chất rắn, hạt nhân và hạt. New York: Wiley
- Mô hình nguyên tử của Bohr-Sommerfeld. Lấy từ: fisquiweb.es
- Joesten, M. (1991). Thế giới hóa học Philadelphia, Pa.: Saunders College Publishing, tr.76-78.
- Modèle de Bohr de l'atome d'hydrogène. Lấy từ fr.khanacademy.org
- Izlar, K. Hồi tưởng lại sur l'atome: le modèle de Bohr a cent ans. Lấy từ: home.cern



