Cấu trúc, tính chất, cách sử dụng và rủi ro của Ethane
các etan là một hydrocarbon đơn giản có công thức C2H6 với bản chất của khí không màu và không mùi có công dụng rất đa dạng và có giá trị trong quá trình tổng hợp ethylene. Ngoài ra, nó là một trong những loại khí trên mặt đất cũng đã được phát hiện trong các hành tinh và các ngôi sao khác xung quanh Hệ Mặt Trời. Nó được phát hiện bởi nhà khoa học Michael Faraday vào năm 1834.
Trong số lượng lớn các hợp chất hữu cơ được hình thành bởi các nguyên tử carbon và hydro (được gọi là hydrocarbon), có những hợp chất ở trạng thái khí ở nhiệt độ và áp suất môi trường, được sử dụng rất nhiều trong nhiều ngành công nghiệp.
Chúng thường đến từ hỗn hợp khí gọi là "khí tự nhiên", một sản phẩm có giá trị cao đối với nhân loại và tạo thành khí metan, metan, propan và butan, cùng với các loại khác; phân loại theo lượng nguyên tử carbon trong chuỗi của nó.
Chỉ số
- 1 Cấu trúc hóa học
- 1.1 Tổng hợp etan
- 2 thuộc tính
- 2.1 Độ hòa tan của etan
- 2.2 Kết tinh etan
- 2.3 Đốt cháy etan
- 2.4 Ethane trong khí quyển và trong các thiên thể
- 3 công dụng
- 3.1 Sản xuất etylen
- 3.2 Đào tạo hóa chất cơ bản
- 3.3 Môi chất lạnh
- 4 rủi ro của ethane
- 5 tài liệu tham khảo
Cấu trúc hóa học
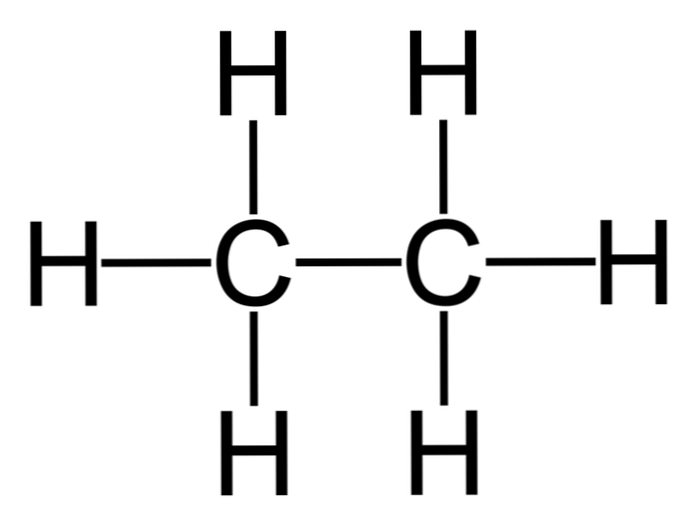
Ethane là một phân tử có công thức C2H6, thường được xem là sự kết hợp của hai nhóm methyl (-CH3) để tạo thành hydrocarbon của một liên kết carbon-carbon đơn giản. Nó cũng là hợp chất hữu cơ đơn giản nhất sau metan, được trình bày như sau:
H3C-CH3
Các nguyên tử carbon trong phân tử này có sự lai hóa sp3, vì vậy các liên kết phân tử thể hiện sự quay tự do.
Ngoài ra, có một hiện tượng nội tại của ethane, dựa trên sự quay của cấu trúc phân tử giống nhau và năng lượng tối thiểu cần thiết để tạo ra một vòng quay liên kết 360 độ, mà các nhà khoa học gọi là "hàng rào ethane".
Vì lý do này, ethane có thể xảy ra trong các cấu hình khác nhau tùy theo vòng quay của nó, mặc dù cấu trúc ổn định hơn của nó tồn tại khi các hydrogens nằm đối diện nhau (như trong hình).

Tổng hợp etan
Ethane có thể được tổng hợp dễ dàng từ quá trình điện phân Kolbe, một phản ứng hữu cơ trong đó xảy ra hai bước: khử carboxyl hóa điện hóa (loại bỏ nhóm carboxyl và giải phóng carbon dioxide) của hai axit carboxylic và kết hợp các sản phẩm trung gian để tạo thành một liên kết cộng hóa trị.
Tương tự như vậy, quá trình điện phân axit axetic dẫn đến sự hình thành ethane và carbon dioxide, và phản ứng này được sử dụng để tổng hợp đầu tiên.
Sự oxy hóa anhydrid acetic do tác dụng của peroxit, một khái niệm tương tự như điện phân của Kolbe, cũng dẫn đến sự hình thành ethane.
Theo cách tương tự, nó có thể được phân tách hiệu quả khỏi khí tự nhiên và metan bằng quy trình hóa lỏng, sử dụng các hệ thống đông lạnh để thu khí này và tách nó ra khỏi hỗn hợp với các khí khác..
Quá trình mở rộng turbo được ưu tiên cho vai trò này: hỗn hợp khí được đưa qua một tuabin, tạo ra sự giãn nở của chúng, cho đến khi nhiệt độ của nó giảm xuống dưới -100ºC.
Tại thời điểm này, các thành phần của hỗn hợp có thể được phân biệt, do đó ethane lỏng sẽ được tách ra khỏi khí metan và các loài khác liên quan đến việc sử dụng chưng cất.
Thuộc tính
Ethane xảy ra trong tự nhiên dưới dạng khí không mùi và không màu ở áp suất và nhiệt độ tiêu chuẩn (1 atm và 25 ° C). Nó có điểm sôi là -88,5 ºC và điểm nóng chảy là -182,8 ºC. Ngoài ra, nó không bị ảnh hưởng khi tiếp xúc với axit hoặc bazơ mạnh.
Độ hòa tan etanol
Các phân tử của ethane có cấu hình đối xứng và có lực hút yếu giữ chúng lại với nhau, được gọi là lực phân tán.
Khi etan được cố gắng hòa tan trong nước, lực hút hình thành giữa chất khí và chất lỏng rất yếu, do đó rất khó kết hợp etan với các phân tử nước.
Vì lý do này, độ hòa tan của ethane thấp đáng kể, tăng nhẹ khi áp suất hệ thống tăng.
Kết tinh etan
Ethane có thể được hóa rắn, dẫn đến sự hình thành các tinh thể ethane không ổn định với cấu trúc tinh thể lập phương.
Với sự giảm nhiệt độ vượt quá -183,2 ° C, cấu trúc này trở nên đơn sắc, làm tăng tính ổn định của phân tử của nó.
Đốt cháy etan
Hydrocarbon này, mặc dù nó không được sử dụng rộng rãi làm nhiên liệu, có thể được sử dụng trong các quá trình đốt cháy để tạo ra carbon dioxide, nước và nhiệt, được thể hiện như sau:
2C2H6 + 7O2 → 4CO2 + 6 giờ2O + 3120 kJ
Ngoài ra còn có khả năng đốt cháy phân tử này mà không cần quá nhiều oxy, được gọi là "đốt cháy không hoàn toàn", và dẫn đến sự hình thành carbon vô định hình và carbon monoxide trong một phản ứng không mong muốn, tùy thuộc vào lượng oxy được áp dụng :
2C2H6 + 3O2 → 4+ + 6H2O + Nhiệt
2C2H6 + 4O2 → 2C + 2CO + 6H2O + Nhiệt
2C2H6 + 5O2 → 4CO + 6H2O + Nhiệt
Trong lĩnh vực này, sự đốt cháy xảy ra thông qua một loạt các phản ứng gốc tự do, được đánh số trong hàng trăm phản ứng khác nhau. Ví dụ, các hợp chất như formaldehyd, acetaldehyd, metan, metanol và ethanol có thể được hình thành trong các phản ứng đốt cháy không hoàn toàn..
Điều này sẽ phụ thuộc vào các điều kiện theo đó phản ứng xảy ra và các phản ứng gốc tự do liên quan. Ethylene cũng có thể được hình thành ở nhiệt độ cao (600-900 ºC), đây là một sản phẩm được ngành công nghiệp mong muốn.
Ethane trong bầu khí quyển và thiên thể
Ethane có mặt trong bầu khí quyển của hành tinh Trái đất trong các dấu vết, và người ta nghi ngờ rằng con người đã xoay sở để tăng gấp đôi nồng độ này kể từ khi anh ta bắt đầu thực hành các hoạt động công nghiệp.
Các nhà khoa học nghĩ rằng phần lớn sự hiện diện của ethane trong khí quyển là do sự đốt cháy nhiên liệu hóa thạch, mặc dù lượng phát thải ethane toàn cầu đã giảm gần một nửa kể từ khi công nghệ sản xuất khí đá phiến được cải thiện (a nguồn khí tự nhiên).
Loài này cũng được tạo ra một cách tự nhiên do tác động của tia mặt trời lên khí mê-tan trong khí quyển, chúng tái hợp và tạo thành một phân tử ethane.
Ethane tồn tại ở trạng thái lỏng trên bề mặt Titan, một trong những mặt trăng của Sao Thổ. Điều này xảy ra với số lượng lớn hơn ở sông Vid Flumina, chảy hơn 400 km về phía một trong những vùng biển của nó. Nó cũng đã được chứng minh hợp chất này trên sao chổi và trên bề mặt Sao Diêm Vương.
Công dụng
Sản xuất etylen
Việc sử dụng ethane chủ yếu dựa vào việc sản xuất ethylene, sản phẩm hữu cơ được sử dụng rộng rãi nhất trong sản xuất thế giới, thông qua một quá trình được gọi là cracking hơi nước..
Quá trình này bao gồm việc đưa một lượng ethane được pha loãng với hơi nước vào lò, làm nóng nó nhanh chóng mà không cần oxy.
Phản ứng xảy ra ở nhiệt độ cực cao (từ 850 đến 900 ºC), nhưng thời gian lưu trú (thời gian sử dụng ethane bên trong lò) phải ngắn gọn để phản ứng có hiệu quả. Ở nhiệt độ cao hơn, nhiều ethylene được tạo ra.
Đào tạo hóa chất cơ bản
Ethane cũng đã được nghiên cứu như là một thành phần chính trong việc hình thành các hóa chất cơ bản. Khử trùng bằng oxy hóa là một trong những quy trình được đề xuất để thu được vinyl clorua (một thành phần của PVC), thay thế các chất ít tốn kém hơn và phức tạp hơn.
Nước làm mát
Cuối cùng, ethane được sử dụng làm chất làm lạnh trong các hệ thống đông lạnh thông thường, cũng cho thấy khả năng đóng băng các mẫu nhỏ trong phòng thí nghiệm để phân tích.
Nó là một chất thay thế rất tốt cho nước, cần nhiều thời gian hơn để làm mát các mẫu mỏng manh và cũng có thể tạo ra sự hình thành các tinh thể băng có hại.
Rủi ro đạo đức
-Ethane có khả năng bắt lửa, đặc biệt là khi nó liên kết với không khí. Với tỷ lệ phần trăm từ 3,0 đến 12,5% thể tích ethane trong không khí, một hỗn hợp nổ có thể hình thành.
-Nó có thể hạn chế oxy trong không khí nơi nó được tìm thấy, và vì lý do này, nó thể hiện một yếu tố nguy cơ gây ngạt thở cho người và động vật có mặt và tiếp xúc.
-Ethane ở dạng lỏng đông lạnh có thể làm bỏng da nghiêm trọng nếu tiếp xúc trực tiếp với nó, và cũng hoạt động như một môi trường đông lạnh cho bất kỳ vật nào nó chạm vào, đóng băng trong giây lát.
-Hơi của ethane lỏng nặng hơn không khí và tập trung trên mặt đất, điều này có thể gây ra nguy cơ đánh lửa có thể tạo ra phản ứng đốt cháy chuỗi.
-Việc uống ethane có thể gây buồn nôn, nôn và chảy máu trong. Hít phải, ngoài nghẹt thở, gây đau đầu, nhầm lẫn và thay đổi tâm trạng. Tử vong do ngừng tim là có thể xảy ra ở mức phơi nhiễm cao.
-Nó đại diện cho một loại khí nhà kính, cùng với khí mê-tan và carbon dioxide, góp phần vào sự nóng lên toàn cầu và biến đổi khí hậu do ô nhiễm của con người. May mắn thay, nó ít phong phú và bền hơn khí mê-tan và hấp thụ ít bức xạ hơn thế này.
Tài liệu tham khảo
- Britannica, E. (s.f.). Ethan. Lấy từ britannica.com
- Không, G. V. (s.f.). Cấu trúc đơn tinh thể và phân bố mật độ electron của ethane, ethylene và acetylene. Phục hồi từ rug.nl
- Trang web, G. (s.f.). Ethane: Nguồn và chìm. Lấy từ trang web.google.com
- Trường học mềm. (s.f.). Công thức etan. Phục hồi từ softschools.com
- Wikipedia. (s.f.). Ethan. Lấy từ en.wikipedia.org


