Cấu trúc amoni hydroxit, tính chất, danh pháp, sử dụng
các hydroxit amoni là hợp chất có công thức phân tử NH4OH hoặc H5KHÔNG được tạo ra bởi sự hòa tan khí amoniac (NH3) trong nước. Vì lý do này, nó nhận được tên của nước amoniac hoặc amoniac lỏng.
Nó là một chất lỏng không màu với mùi rất nồng và mạnh, không cách nhiệt. Những đặc điểm này có mối quan hệ trực tiếp với nồng độ NH3 hòa tan trong nước; nồng độ trong thực tế, là một chất khí, có thể bao phủ một lượng lớn chất hòa tan trong một lượng nhỏ nước.
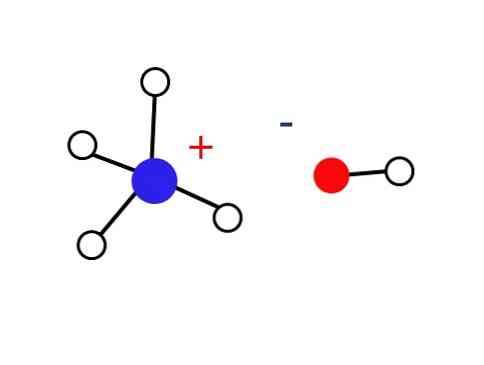
Một phần nhỏ đáng kể của các dung dịch nước này bao gồm các cation NH4+ và anion OH-. Mặt khác, trong các dung dịch rất loãng hoặc trong chất rắn đông lạnh ở nhiệt độ rất thấp, amoniac có thể được tìm thấy ở dạng hydrat, chẳng hạn như: NH3H2Ô, 2NH3H2O và NH32H2Ôi.
Như một sự thật tò mò, những đám mây của Sao Mộc được hình thành bởi các dung dịch amoni hydroxit loãng. Tuy nhiên, tàu thăm dò vũ trụ Galileo đã không tìm thấy nước trong các đám mây của hành tinh, điều được mong đợi từ kiến thức rằng sự hình thành của amoni hydroxit đã được biết đến; đó là những tinh thể NH4OH hoàn toàn khan.
Các ion amoni (NH4+) được sản xuất trong lòng ống thận bởi sự kết hợp của amoniac và hydro, được tiết ra bởi các tế bào ống thận. Tương tự như vậy, amoni được sản xuất trong các tế bào ống thận trong quá trình biến đổi glutamine thành glutamate, và lần lượt, trong quá trình chuyển đổi glutamate thành α-ketoglutarate.
Amoniac được sản xuất công nghiệp theo phương pháp Haber-Bosch, trong đó khí nitơ và hydro được phản ứng; sử dụng ion sắt, oxit nhôm và oxit kali làm chất xúc tác. Phản ứng được thực hiện ở áp suất cao (150 - 300 atm) và nhiệt độ cao (400-500 ºC), với hiệu suất 10-20%.
Trong phản ứng, amoniac được tạo ra, khi bị oxy hóa sẽ tạo ra nitrit và nitrat. Đây là những chất cần thiết để thu được axit nitric và phân bón như amoni nitrat.
Chỉ số
- 1 Cấu trúc hóa học
- 1.1 Băng ammoniac
- 2 Tính chất lý hóa
- 2.1 Công thức phân tử
- 2.2 Trọng lượng phân tử
- 2.3 Ngoại hình
- 2.4 Nồng độ
- Mùi 2,5
- 2.6 Hương vị
- 2.7 Giá trị ngưỡng
- 2.8 Điểm sôi
- 2.9 Độ hòa tan
- 2.10 Độ hòa tan trong nước
- 2.11 Mật độ
- 2.12 Mật độ hơi
- 2.13 Áp suất hơi
- 2.14 Hành động ăn mòn
- 2,15 pH
- 2.16 Hằng số phân ly
- 3 danh pháp
- 4 Độ hòa tan
- 5 rủi ro
- 5.1 Độ phản ứng
- 6 công dụng
- 6.1 Trong thực phẩm
- 6.2 Trị liệu
- 6.3 Công nghiệp và linh tinh
- 6.4 Trong nông nghiệp
- 7 tài liệu tham khảo
Cấu trúc hóa học
Theo định nghĩa của nó, amoni hydroxit bao gồm một dung dịch khí amoniac. Do đó, trong chất lỏng, không có cấu trúc xác định nào ngoài cấu trúc ngẫu nhiên của các ion NH4+ và OH- hòa tan bởi các phân tử nước.
Các ion amoni và hydroxyl là sản phẩm của trạng thái cân bằng thủy phân amoniac, do đó, thông thường các giải pháp này có mùi hăng:
NH3(g) + H2Ô (l) <=> NH4+(ac) + OH-(ac)
Theo phương trình hóa học, nồng độ nước giảm cao sẽ làm thay đổi trạng thái cân bằng sang sự hình thành nhiều amoniac hơn; nghĩa là, khi amoni hydroxit được đun nóng, hơi amoniac sẽ được giải phóng.
Vì lý do này, các ion NH4+ và OH- họ không thể tạo thành một tinh thể trong điều kiện trên mặt đất, điều mang lại hậu quả như NH cơ sở vững chắc4OH không tồn tại.
Chất rắn này chỉ nên bao gồm các ion tương tác tĩnh điện (như trong hình).
Băng ammoniac
Tuy nhiên, dưới nhiệt độ dưới 0 độ C, và được bao quanh bởi những áp lực to lớn, chẳng hạn như những hạt chiếm ưu thế trong hạt nhân của mặt trăng băng giá, amoniac và nước đóng băng. Khi làm như vậy, chúng kết tinh thành một hỗn hợp rắn với tỷ lệ cân bằng hóa học khác nhau, là NH đơn giản nhất3H2O: amoniac monohydrat.
NH3H2O và NH32H2Hoặc chúng là băng ammoniac, bởi vì chất rắn bao gồm sự sắp xếp tinh thể của các phân tử nước và amoniac được nối với nhau bằng liên kết hydro.
Theo sự thay đổi của T và P, theo các nghiên cứu tính toán mô phỏng tất cả các biến vật lý và tác động của chúng đối với các băng này, sự chuyển đổi của pha NH xảy ra3∙ nH2Hoặc đến giai đoạn NH4OH.
Do đó, chỉ trong những điều kiện khắc nghiệt này, NH4OH có thể tồn tại như một sản phẩm của một proton trong băng giữa NH3 và H2Ôi
NH3(s) + H2Ô (s) <=> NH4OH (s)
Lưu ý rằng lần này, không giống như sự thủy phân amoniac, các loài liên quan đang ở trong một pha rắn. Một băng ammoniac trở nên mặn mà không giải phóng amoniac.
Tính chất hóa lý
Công thức phân tử
NH4OH hoặc H5KHÔNG
Trọng lượng phân tử
35.046 g / mol
Ngoại hình
Nó là một chất lỏng không màu.
Nồng độ
Lên đến khoảng 30% (đối với các ion NH4+ và OH-).
Mùi
Rất mạnh mẽ và sắc nét.
Hương vị
Mẫu Anh.
Giá trị ngưỡng
34 ppm cho phát hiện không cụ thể.
Điểm sôi
38 ºC (25%).
Độ hòa tan
Nó chỉ tồn tại trong dung dịch nước.
Độ hòa tan trong nước
Có thể trộn với tỷ lệ không giới hạn.
Mật độ
0,90 g / cm3 ở 25 ºC.
Mật độ hơi
Liên quan đến không khí lấy theo đơn vị: 0,6. Đó là, nó ít đậm đặc hơn không khí. Tuy nhiên, về mặt logic, giá trị được báo cáo đề cập đến amoniac như một loại khí, không phải là dung dịch nước hoặc NH4OH.
Áp suất hơi
2.160 mmHg ở 25 ºC.
Hành động ăn mòn
Nó có khả năng hòa tan kẽm và đồng.
pH
11,6 (dung dịch 1 N); 11.1 (giải pháp 0.1 N) và 10,6 (dung dịch 0,01 N).
Hằng số phân ly
pKb = 4,767; Kb = 1,71 x 10-5 ở 20 ºC
pKb = 4,751; Kb = 1.774 x 10-5 ở 25 º C.
Sự gia tăng nhiệt độ làm tăng gần như không thể nhận ra tính cơ bản của amoni hydroxit.
Danh pháp
Tất cả các tên phổ biến và chính thức mà NH nhận được là gì?4OH? Theo những gì được thành lập bởi IUPAC, tên của nó là amoni hydroxit vì nó chứa anion hydroxyl.
Amoni theo tải trọng +1 của nó là đơn trị, lý do tại sao sử dụng danh pháp Stock nó được đặt tên là: ammonium hydroxide (I).
Mặc dù việc sử dụng thuật ngữ amoni hydroxit là không chính xác về mặt kỹ thuật, vì hợp chất này không thể phân lập được (ít nhất là không có trên Trái đất, như được giải thích chi tiết trong phần đầu tiên).
Ngoài ra, amoni hydroxit nhận được tên của nước amoniac và amoniac lỏng.
Độ hòa tan
NH4OH, vì không có muối trong điều kiện trên cạn, nên không thể ước tính mức độ hòa tan của nó trong các dung môi khác nhau.
Tuy nhiên, người ta kỳ vọng nó sẽ cực kỳ hòa tan trong nước, vì sự hòa tan của nó sẽ giải phóng một lượng NH lớn3. Về mặt lý thuyết, nó sẽ là một cách tuyệt vời để lưu trữ và vận chuyển amoniac.
Trong các dung môi khác có khả năng chấp nhận các liên kết hydro, như rượu và amin, có thể dự kiến rằng nó cũng sẽ rất hòa tan trong chúng. Đây là cation NH4+ là một nhà tài trợ của cầu hydro và OH- nó hoạt động như cả hai.
Ví dụ về các tương tác này với methanol sẽ là: H3N+-H - OHCH3 và HO- - GIỜ3 (OHCH3 chỉ ra rằng oxy nhận được liên kết hydro, không phải là nhóm methyl được liên kết với H).
Rủi ro
-Tiếp xúc với mắt gây ra kích ứng có thể dẫn đến tổn thương mắt.
-Nó ăn mòn. Do đó, khi tiếp xúc với da có thể gây kích ứng và ở nồng độ cao của thuốc thử, gây bỏng da. Sự tiếp xúc lặp đi lặp lại của ammonium hydroxide với da có thể gây khô, ngứa và đỏ (viêm da).
-Hít phải một loại thuốc xịt amoni hydroxit có thể gây kích ứng cấp tính cho đường hô hấp, đặc trưng bởi nghẹt thở, ho hoặc khó thở. Phơi nhiễm kéo dài hoặc lặp đi lặp lại của chất có thể dẫn đến nhiễm trùng phế quản tái phát. Ngoài ra, việc hít phải amoni hydroxit có thể gây kích ứng phổi.
-Phơi nhiễm với nồng độ ammonium hydroxide cao có thể là một cấp cứu y tế, vì sự tích tụ chất lỏng trong phổi (phù phổi) có thể xảy ra.
-Nồng độ 25 ppm được coi là giới hạn phơi nhiễm, trong ca làm việc kéo dài 8 giờ, trong môi trường mà công nhân tiếp xúc với tác động có hại của amoni hydroxit.
Khả năng phản ứng
-Ngoài ra, về các thiệt hại sức khỏe tiềm ẩn do tiếp xúc với amoni hydroxit, có những biện pháp phòng ngừa khác phải được tính đến khi làm việc với chất này.
-Amoni hydroxit có thể phản ứng với nhiều kim loại, như: bạc, đồng, chì và kẽm. Nó cũng phản ứng với muối của các kim loại này để tạo thành các hợp chất nổ và giải phóng khí hydro; trong đó, lần lượt là dễ cháy và nổ.
-Nó có thể phản ứng dữ dội với các axit mạnh, ví dụ: axit hydrochloric, axit sulfuric và axit nitric. Tương tự như vậy, nó phản ứng theo cách tương tự với dimethyl sulfate và halogen.
-Phản ứng với các bazơ mạnh, chẳng hạn như natri hydroxit và kali hydroxit, tạo ra khí amoniac. Điều này có thể được kiểm tra nếu quan sát được trạng thái cân bằng trong dung dịch, trong đó việc bổ sung các ion OH- chuyển số dư sang hình thành NH3.
-Kim loại đồng và nhôm, cũng như các kim loại mạ kẽm khác, không nên được sử dụng khi xử lý amoni hydroxit, do tác động ăn mòn của chúng đối với chúng..
Công dụng
Trong thức ăn
-Nó được sử dụng như một chất phụ gia trong nhiều loại thực phẩm, trong đó nó hoạt động như một chất men, kiểm soát pH và chất hoàn thiện của bề mặt thực phẩm..
-Danh sách các loại thực phẩm trong đó ammonium hydroxide được sử dụng rộng rãi và bao gồm các món nướng, pho mát, sôcôla, kẹo và bánh pudding.
-Ammonium hydroxide được FDA phân loại là chất an toàn để chế biến thực phẩm, với điều kiện phải tuân thủ các tiêu chuẩn đã được thiết lập.
-Trong các sản phẩm thịt, nó được sử dụng như một chất chống vi trùng, có khả năng loại bỏ vi khuẩn như E.coli, làm giảm đến mức không thể phát hiện. Các vi khuẩn được tìm thấy trong ruột của gia súc, thích nghi với môi trường axit. Amoni hydroxit, bằng cách điều chỉnh pH, cản trở sự phát triển của vi khuẩn.
Trị liệu
-Amoni hydroxit có một số công dụng chữa bệnh, bao gồm:
-Dung dịch 10% được sử dụng làm chất kích thích phản xạ hô hấp
-Bên ngoài nó được sử dụng trên da để điều trị vết côn trùng cắn và vết cắn - Nó hoạt động trên hệ thống tiêu hóa dưới dạng thuốc kháng axit và thuốc chữa bệnh, nghĩa là nó giúp loại bỏ khí.
Ngoài ra, nó được sử dụng như một rubefacient tại chỗ cho đau cơ xương khớp cấp tính và mãn tính. Do hậu quả của hoạt động rubefacient của ammonium hydroxide, có sự gia tăng cục bộ lưu lượng máu, đỏ và kích ứng.
Công nghiệp và linh tinh
-Nó hoạt động trong việc khử NOx (các khí phản ứng cao như oxit nitric (NO) và nitơ dioxide (NO2)) cho phát thải ngăn xếp và giảm NOx trong phát thải ống khói.
-Nó được sử dụng như một chất làm dẻo; Phụ gia của sơn và xử lý bề mặt.
-Nó làm tăng độ xốp của tóc cho phép các sắc tố của vết bẩn có độ thâm nhập lớn hơn, giúp đạt được kết thúc tốt hơn.
-Amoni hydroxit được sử dụng như một chất chống vi trùng trong xử lý nước thải. Ngoài ra, nó can thiệp vào quá trình tổng hợp chloramine. Chất này đáp ứng một chức năng tương tự như clo trong việc lọc nước bể bơi, có ưu điểm là ít độc hơn.
-Nó được sử dụng như một chất ức chế ăn mòn trong quá trình lọc dầu.
-Nó được sử dụng làm chất tẩy rửa trong các sản phẩm công nghiệp và thương mại khác nhau, được sử dụng trên một số bề mặt, bao gồm: thép không gỉ, sứ, thủy tinh và lò nướng.
-Ngoài ra, nó được sử dụng trong sản xuất chất tẩy rửa, xà phòng, dược phẩm và mực.
Trong nông nghiệp
Mặc dù không được sử dụng trực tiếp dưới dạng phân bón, ammonium hydroxide đáp ứng chức năng này. Amoniac được sản xuất từ nitơ trong khí quyển bằng phương pháp Haber-Bosch và được vận chuyển trong tủ lạnh dưới điểm sôi của nó (-33 ° C) đến các vị trí sử dụng.
Amoniac được điều áp được bơm, ở dạng hơi, vào đất nơi nó ngay lập tức phản ứng với nước edaphic và chuyển sang dạng amoni (NH4+), được giữ lại trong các vị trí trao đổi cation đất. Ngoài ra, amoni hydroxit được sản xuất. Các hợp chất này là một nguồn nitơ.
Cùng với phốt pho và kali, nitơ tạo thành bộ ba chất dinh dưỡng chính của thực vật cần thiết cho sự tăng trưởng của nó.
Tài liệu tham khảo
- Ganong, W. F. (2002). Sinh lý học y tế. Phiên bản thứ 19. Biên tập hướng dẫn hiện đại.
- A. D. Fortes, J. P. Brodholt, I. G. Wood và L. Vocadlo. (2001). Mô phỏng abioio của amoniac monohydrat (NH3H2O) và amoni hydroxit (NH4OH). Viện Vật lý Hoa Kỳ. J. chem. Phys., Tập 115, số 15, 15.
- Helmenstine, Anne Marie, Tiến sĩ (Ngày 6 tháng 2 năm 2017). Ammonium Hydroxide. Lấy từ: thinkco.com
- Tập đoàn Pochteca. (2015). Hydroxit amoni. pochteca.com
- Sức khỏe NJ (s.f.). Tờ thông tin về các chất độc hại: amoni hydroxit. [PDF] Lấy từ: nj.gov
- Học viên hóa học. (2018). Hydroxit amoni. Lấy từ: chemlearner.com
- PubChem. (2018). Hydroxit amoni. Lấy từ: pubool.ncbi.nlm.nih.gov


