Quá trình phản ứng tỏa nhiệt, các loại và ví dụ
các phản ứng tỏa nhiệt là một loại phản ứng hóa học trong đó xảy ra sự truyền năng lượng, chủ yếu ở dạng giải phóng nhiệt hoặc ánh sáng. Tên đến từ tiền tố Hy Lạp exo, có nghĩa là "ở nước ngoài"; và thuật ngữ "nhiệt", dùng để chỉ nhiệt hoặc nhiệt độ.
Theo nghĩa này, các phản ứng tỏa nhiệt có thể truyền các loại năng lượng khác vào môi trường nơi chúng được tạo ra, chẳng hạn như với vụ nổ và cách truyền năng lượng động học và âm thanh của chúng khi các chất ở pha khí ở nhiệt độ cao được mở rộng. cách bạo lực.
Theo cách tương tự, trong trường hợp sử dụng pin, một phản ứng tỏa nhiệt cũng được thực hiện, chỉ trong trường hợp này năng lượng điện được vận chuyển.
Chỉ số
- 1 quá trình
- 2 loại
- 2.1 Phản ứng đốt cháy
- 2.2 Phản ứng trung hòa
- 2.3 Phản ứng oxy hóa
- 2.4 Phản ứng diệt mối
- 2.5 Phản ứng trùng hợp
- 2.6 Phản ứng phân hạch hạt nhân
- 2.7 Phản ứng khác
- 3 ví dụ
- 4 tài liệu tham khảo
Quy trình
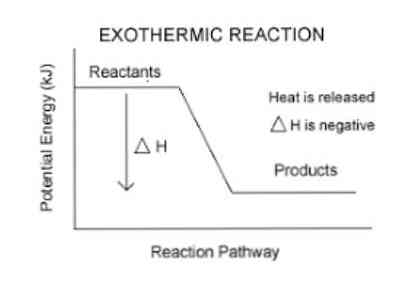
Trước đây, người ta đã đề cập rằng khi xảy ra phản ứng tỏa nhiệt, sự giải phóng năng lượng xảy ra, có thể được hình dung dễ dàng hơn trong phương trình sau:
Thuốc thử → Sản phẩm + Năng lượng
Vì vậy, để định lượng năng lượng được hấp thụ hoặc giải phóng bởi một hệ thống, một tham số nhiệt động gọi là enthalpy (ký hiệu là "H") được sử dụng. Nếu trong một hệ thống (trong trường hợp này là phản ứng hóa học) có sự giải phóng năng lượng ra môi trường xung quanh, thì sự biến đổi của entanpy (được biểu thị bằng ΔH) sẽ có giá trị âm.
Mặt khác, nếu sự thay đổi của biện pháp này là tích cực, nó phản ánh sự hấp thụ nhiệt từ môi trường xung quanh. Ngoài ra, mức độ biến thiên entanpy của hệ thống là biểu hiện của lượng năng lượng được truyền đến hoặc từ môi trường.
Độ lớn của ΔH càng lớn, sự giải phóng năng lượng từ hệ thống đến môi trường xung quanh càng lớn.
Điều này là do trong các phản ứng này, năng lượng ròng được giải phóng khi các liên kết mới được tạo ra lớn hơn năng lượng ròng được sử dụng trong sự phân mảnh của các liên kết.
Từ những điều trên có thể suy ra rằng loại phản ứng này rất phổ biến, bởi vì các sản phẩm của phản ứng có một lượng năng lượng được lưu trữ trong các liên kết lớn hơn những gì có trong các chất phản ứng..
Các loại
Có nhiều loại phản ứng tỏa nhiệt khác nhau trong các lĩnh vực hóa học khác nhau, cho dù trong phòng thí nghiệm hay trong công nghiệp; một số được thực hiện một cách tự nhiên và một số khác cần điều kiện cụ thể hoặc một số loại chất như chất xúc tác được sản xuất.
Sau đây là các loại phản ứng tỏa nhiệt quan trọng nhất:
Phản ứng đốt cháy
Các phản ứng đốt cháy là các loại oxi hóa khử xảy ra khi một hoặc nhiều chất phản ứng với oxy, thường dẫn đến sự giải phóng ánh sáng và năng lượng nhiệt - đó là, ánh sáng và nhiệt - khi ngọn lửa được tạo ra..
Phản ứng trung hòa
Phản ứng trung hòa được đặc trưng bởi sự tương tác giữa một loại axit và một chất kiềm (bazơ) để tạo thành muối và nước, biểu hiện một tính chất tỏa nhiệt.
Phản ứng oxy hóa
Có nhiều phản ứng thuộc loại này cho thấy một hành vi tỏa nhiệt, bởi vì quá trình oxy hóa oxy gây ra sự giải phóng một lượng lớn năng lượng, như xảy ra trong quá trình oxy hóa hydrocarbon..
Phản ứng diệt mối
Phản ứng này có thể tạo ra nhiệt độ khoảng 3000 ° C, và do ái lực cao của bột nhôm với số lượng lớn các oxit kim loại, nó được sử dụng trong hàn thép và sắt.
Phản ứng trùng hợp
Loại phản ứng này là loại phản ứng bắt nguồn khi một số loại hóa chất nhất định gọi là monome phản ứng, là đơn vị khi kết hợp lại được lặp lại trong chuỗi để tạo thành cấu trúc phân tử gọi là polyme.
Phản ứng phân hạch hạt nhân
Quá trình này đề cập đến sự phân chia hạt nhân của một nguyên tử được coi là nặng - nghĩa là có số khối (A) lớn hơn 200 - để tạo ra các mảnh hoặc hạt nhân có kích thước nhỏ hơn với khối lượng trung gian.
Trong phản ứng này, nơi một hoặc nhiều neutron được hình thành, một lượng lớn năng lượng được giải phóng vì lõi có trọng lượng lớn hơn có độ ổn định thấp hơn các sản phẩm của nó.
Phản ứng khác
Ngoài ra còn có các phản ứng tỏa nhiệt khác có liên quan rất lớn, chẳng hạn như mất nước của một số carbohydrate khi phản ứng với axit sulfuric, sự hấp thụ nước có natri hydroxit tiếp xúc với không khí mở hoặc oxy hóa các loài kim loại trong nhiều phản ứng ăn mòn.
Ví dụ
Dưới đây là một số ví dụ về các phản ứng tỏa nhiệt, tạo ra một biến thể của entanpy có giá trị âm do thực tế là chúng giải phóng năng lượng, như đã đề cập ở trên..
Ví dụ, sự đốt cháy propan là một phản ứng tỏa nhiệt tự phát:
C3H8(g) + 5O2(g) → 3CO2(g) + 4H2Ô (l)
Một trường hợp khác về hành vi tỏa nhiệt được thể hiện bằng phản ứng trung hòa giữa natri cacbonat và axit clohydric:
NaHCO3(ac) + HCl (ac) → NaCl (ac) + H2O (l) + CO2(g)
Quá trình oxy hóa ethanol thành axit axetic được sử dụng trong ống thở cũng được trình bày, có phản ứng hoàn toàn được thể hiện trong phương trình sau:
3CH3CH2OH + 2K2Cr2Ôi7 + 8 giờ2VẬY4 → CH3COOH + 2Cr (SO4)3 + 2K2VẬY4 + 11 giờ2Ôi
Một loại phản ứng tỏa nhiệt khác là phản ứng nhiệt gọi là phản ứng nhiệt, trong đó nhôm được kết hợp với oxit kim loại, như được minh họa dưới đây:
2Al (s) + Niềm tin2Ôi3(s) → Al2Ôi3(s) + Fe (l)
Ngoài các ví dụ được giải thích ở trên, có rất nhiều phản ứng cũng được coi là tỏa nhiệt, chẳng hạn như phân hủy một số chất thải hữu cơ để làm phân trộn..
Nó cũng làm nổi bật quá trình oxy hóa sắc tố luciferin bằng hoạt động của enzyme luciferase để tạo ra đặc tính phát quang sinh học của đom đóm và thậm chí cả hơi thở, trong số nhiều phản ứng khác.
Tài liệu tham khảo
- Wikipedia. (s.f.). Phản ứng tỏa nhiệt. Lấy từ es.wikipedia.org
- BBC (s.f.). Thay đổi năng lượng và phản ứng thuận nghịch. Lấy từ bbc.co.uk
- Chang, R. (2007). Hóa học, phiên bản thứ chín. (Đồi McGraw).
- Walker, D. (2007). Phản ứng hóa học. Lấy từ sách.google.com.vn
- Saunders, N. (2007). Khám phá các phản ứng hóa học. Lấy từ sách.google.com.vn


