Ziehl-Neelsen Stain Foundation, Thuốc thử và Kỹ thuật
các Vết bẩn Ziehl-Neelsen trong một kỹ thuật tạo màu để xác định các vi sinh vật kháng axit (AAR). Tên của quy trình vi sinh này đề cập đến các tác giả của nó: nhà vi khuẩn học Franz Ziehl và nhà nghiên cứu bệnh học Friedrich Neelsen.
Kỹ thuật này là một loại màu khác biệt, ngụ ý việc sử dụng các loại thuốc nhuộm khác nhau để tạo độ tương phản giữa các cấu trúc mà bạn muốn quan sát, phân biệt và sau đó xác định. Vết Ziehl-Neelsen được sử dụng để xác định một số loại vi sinh vật.
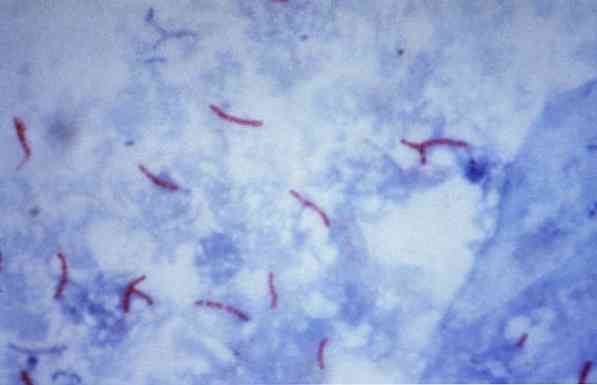
Một số vi sinh vật này là vi khuẩn mycobacteria (ví dụ, Mycobacterium tuberculosis), nocardias (ví dụ, Nocardia sp.) và một số ký sinh trùng đơn bào (ví dụ, Cryptosporidium parvum). Nhiều vi khuẩn có thể được phân loại thông qua một kỹ thuật phổ biến được gọi là nhuộm Gram.
Tuy nhiên, một số nhóm vi khuẩn yêu cầu các phương pháp khác để xác định chúng. Các kỹ thuật như nhuộm Ziehl-Neelsen yêu cầu kết hợp thuốc nhuộm với nhiệt để cố định đầu tiên vào thành tế bào.
Sau đó là quá trình đổi màu cho phép hai kết quả: kháng hoặc nhạy cảm với sự đổi màu của axit và rượu.
Chỉ số
- 1 nền tảng
- 1.1 Tô màu thứ cấp
- 2 thuốc thử
- 2.1 Màu chính
- 2.2 Dung dịch khử màu
- 2.3 Màu thứ cấp (chống màu)
- 3 Kỹ thuật
- 3.1 Quy trình nhuộm axit nhanh
- 4 tài liệu tham khảo
Nền tảng
Cơ sở của kỹ thuật nhuộm màu này dựa trên đặc tính thành tế bào của các vi sinh vật này. Bức tường được hình thành bởi một loại axit béo gọi là axit mycolic; Chúng được đặc trưng bởi các chuỗi rất dài.
Khi axit béo có cấu trúc rất dài, chúng có thể giữ thuốc nhuộm dễ dàng hơn. Một số chi vi khuẩn rất khó nhuộm màu do nhuộm Gram, do hàm lượng axit mycolic cao trong thành tế bào.
Trong vết Ziehl-Neelsen, hợp chất phenol carbol fuchsin, một loại thuốc nhuộm cơ bản, được sử dụng. Điều này có khả năng tương tác với các axit béo của thành tế bào, đó là kết cấu sáp ở nhiệt độ phòng.
Nhuộm carbol fuchsin được cải thiện khi có nhiệt, vì sáp tan chảy và các phân tử thuốc nhuộm di chuyển nhanh hơn vào thành tế bào.
Axit được sử dụng sau này dùng để làm mất màu các tế bào không bị ố vì thành của chúng không đủ liên quan đến chất màu; do đó, độ mạnh của chất khử màu axit có khả năng loại bỏ thuốc nhuộm axit. Các tế bào chống lại sự đổi màu này được gọi là kháng axit.
Tô màu thứ cấp
Sau khi đổi màu của mẫu, điều này tương phản với một thuốc nhuộm khác gọi là thuốc nhuộm thứ cấp. Màu xanh methylen hoặc xanh malachite thường được sử dụng.
Thuốc nhuộm thứ cấp nhuộm màu vật liệu nền và, do đó, tạo ra sự tương phản với các cấu trúc đã được nhuộm trong bước đầu tiên. Chỉ các tế bào bị đổi màu mới hấp thụ thuốc nhuộm thứ hai (chống vết bẩn) và lấy màu của chúng, trong khi các tế bào kháng axit giữ lại màu đỏ.
Thủ tục này thường được sử dụng để xác định Mycobacterium tuberculosis và Mycobacterium leprae, được gọi là trực khuẩn axit nhanh.
Thuốc thử
Tô màu chính
Carboxin 0,3% fuchsin (được lọc) được sử dụng. Thuốc nhuộm này được điều chế từ hỗn hợp rượu: phenol trong ethanol (90%) hoặc metanol (95%), và trong hỗn hợp này, 3 gram fuchsin cơ bản được hòa tan.
Dung dịch khử màu
Trong bước này, bạn có thể sử dụng dung dịch axit 3% hoặc axit sunfuric 25%.
Chất tạo màu thứ cấp (chống màu)
Thuốc nhuộm được sử dụng phổ biến nhất để thực hiện độ tương phản trong các mẫu thường là 0,3% xanh methylen. Tuy nhiên, những thứ khác cũng có thể được sử dụng, chẳng hạn như 0,5% malachite xanh.
Kỹ thuật
Quy trình nhuộm axit nhanh
Chuẩn bị một phết vi khuẩn
Chuẩn bị này được thực hiện trên một slide sạch và khô, tuân theo các biện pháp phòng ngừa vô trùng.
Làm khô vết bẩn
Để vết bẩn khô ở nhiệt độ phòng.
Làm nóng mẫu
Mẫu phải được làm nóng bằng cách đốt lửa vào slide bên dưới. Một sự cố định với rượu có thể được thực hiện khi vết bẩn chưa được chuẩn bị bằng đờm (được xử lý bằng sodium hypochlorite để làm trắng nó) và nếu nó sẽ không được nhuộm ngay lập tức..
M. bệnh lao Nó được loại bỏ bằng thuốc tẩy và trong quá trình nhuộm. Nhiệt của đờm không được điều trị sẽ không giết chết M. bệnh lao, trong khi đó cố định với rượu là diệt khuẩn.
Che vết bẩn
Vết bẩn được phủ bằng dung dịch carbol fuchsin (vết bẩn cơ bản chính).
Làm nóng vết bẩn
Điều này được thực hiện trong 5 phút. Bạn sẽ nhận thấy một sự giải phóng hơi (khoảng 60 ° C). Điều quan trọng là không quá nóng và tránh làm cháy mẫu.
Đối với việc làm nóng vết bẩn, phải hết sức cẩn thận khi làm nóng carbol fuchsin, đặc biệt nếu nhuộm được thực hiện trên khay hoặc vật chứa khác trong đó hóa chất dễ cháy đã được thu thập từ vết bẩn trước.
Chỉ nên sử dụng một ngọn lửa nhỏ dưới các phiến bằng cách sử dụng tăm bông được làm sáng trước đó được làm ẩm bằng một vài giọt rượu axit, metanol hoặc ethanol 70%. Tránh sử dụng tăm bông lớn ngâm trong ethanol vì đây là một nguy cơ hỏa hoạn.
Rửa vết bẩn
Rửa này nên được thực hiện với nước sạch. Nếu nước máy không sạch, hãy rửa vết bẩn bằng nước lọc hoặc nước cất, tốt nhất là.
Che vết bẩn bằng cồn axit
Rượu axit này nên ở mức 3%. Bảo hiểm được thực hiện trong 5 phút hoặc cho đến khi vết bẩn đủ màu, nghĩa là, màu hồng nhạt.
Nó phải được xem xét rằng rượu axit là dễ cháy; do đó, nó phải được sử dụng rất cẩn thận. Tránh ở gần nguồn đánh lửa.
Rửa vết bẩn
Nên rửa bằng nước cất, sạch.
Che vết bẩn bằng thuốc nhuộm
Nó có thể là thuốc nhuộm malachite màu xanh lá cây (0,5%) hoặc xanh methylen (0,3%) trong 1 hoặc 2 phút, sử dụng thời gian lâu nhất nếu vết bẩn mỏng.
Rửa vết bẩn
Nước sạch phải được sử dụng lại (chưng cất).
Cống
Mặt sau của slide nên được làm sạch và vết bẩn nên được đặt trên kệ thoát nước, để nó được làm khô bằng không khí (không sử dụng giấy thấm để sấy khô).
Kiểm tra vết bẩn trong kính hiển vi
Mục tiêu 100X và dầu ngâm nên được sử dụng. Quét vết bẩn một cách có hệ thống và viết ra các quan sát liên quan.
Giải thích kết quả
Về mặt lý thuyết, các vi sinh vật được nhuộm màu đỏ được coi là dương tính với axit nhanh (AAR +).
Ngược lại, nếu các vi sinh vật được nhuộm màu xanh lam hoặc xanh lục, tùy thuộc vào thuốc nhuộm được sử dụng làm thuốc nhuộm ngược, chúng được coi là axit kháng cồn âm tính (AAR-).
Tài liệu tham khảo
- Apurba, S. & Sandhya, B. (2016). Yếu tố cần thiết của vi sinh thực hành (Tái bản lần 1). Nhà xuất bản y tế Jaypee Brothers.
- Bauman, R. (2014). Vi sinh vật với các bệnh do hệ thống cơ thể (tái bản lần thứ 4). Pearson Giáo dục, Inc.
- Di sản, J., Evans, E. & Killington, A. (1996). Vi sinh vật nhập môn (Tái bản lần 1). Nhà xuất bản Đại học Cambridge.
- Morello, J., Granato, P. Wilson, M. & Morton, V. (2006). Sổ tay Phòng thí nghiệm và Sách bài tập về Vi sinh vật: Ứng dụng cho Chăm sóc Bệnh nhân (Tái bản lần thứ 11). Giáo dục McGraw-Hill.
- Vasanthakumari, R. (2007). Sách giáo khoa vi sinh (Tái bản lần 1). B.I. Ấn phẩm PVT.


