Cấu trúc, tính chất và công dụng của Natri Bromide (NaBr)
các natri bromua là một loại hóa chất thuộc về muối có nguồn gốc vô cơ. Cấu trúc của nó bao gồm halogen bromo và nguyên tố kim loại natri theo tỷ lệ 1: 1. Công thức hóa học của nó là NaBr và ở trạng thái kết tụ rắn trong điều kiện nhiệt độ và áp suất tiêu chuẩn (25 ° C và 1 atm).
Thông thường nó có thể được quan sát như một loại bột trắng, và nó được coi là một hợp chất loại tinh thể cũng biểu hiện một hành vi hút ẩm; nghĩa là, nó có khả năng hấp thụ độ ẩm từ môi trường xung quanh.

Tương tự, natri bromide có các đặc tính vật lý rất giống với một hợp chất ion khác có cùng kim loại: natri clorua. Clorua này được đại diện là NaCl, thường được gọi là muối thông thường hoặc muối ăn.
Nó có một số lượng lớn sử dụng trong các lĩnh vực khoa học khác nhau; ví dụ, nó được sử dụng trong sản xuất các loại thuốc khác nhau (thuốc an thần, thuốc ngủ, thuốc chống co giật, trong số những loại khác), cũng như trong tổng hợp hữu cơ và thậm chí trong các ứng dụng nhiếp ảnh.
Chỉ số
- 1 Cấu trúc hóa học
- 1.1 Tổng hợp hóa học
- 2 thuộc tính
- 3 công dụng
- 4 tài liệu tham khảo
Cấu trúc hóa học
Như đã đề cập trước đây, natri bromide xảy ra trong pha rắn và, giống như nhiều muối khác có bản chất vô cơ, có cấu trúc cấu trúc tinh thể.
Phân tử tinh thể này, bao gồm một nguyên tử brom và một nguyên tử hydro, có một dạng khối lập phương tập trung trên các mặt, chẳng hạn như các muối haloidal của cùng một kim loại (NaI, NaF và NaCl).
Sự sắp xếp phân tử này tạo thành cơ sở cấu trúc của nhiều hợp chất, trong đó việc sắp xếp thứ tự được thực hiện sao cho mỗi ion được giữ ở trung tâm của hình bát diện, như trong hình dưới đây.
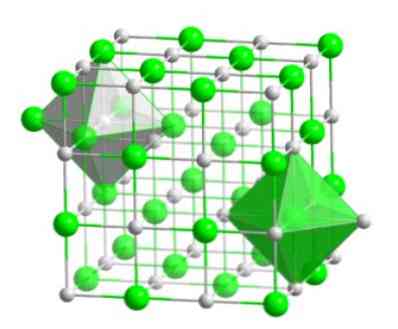
Trong loại tinh thể này, bạn có thể thấy mỗi ion có xung quanh nó như thế nào sáu ion khác - trong đó có một điện tích trái dấu - nằm ở hai đầu của hình bát diện.
Ngoài ra, cấu trúc của chất ion này ngụ ý rằng nó có nhiệt độ nóng chảy cao khoảng 747 ° C, được thương mại hóa ở hai dạng: một loài khan (không có phân tử nước) và một loài bị mất nước (có hai phân tử nước Công thức cấu tạo (NaBr · 2H2O)), có điểm nóng chảy khác nhau.
Tổng hợp hóa học
Natri bromide được gây ra bởi phản ứng hóa học xảy ra giữa hydro bromide (BrH, một halogen hydro trong pha khí) và natri hydroxit (NaOH, một bazơ mạnh trong pha rắn và có đặc tính hút ẩm).
Theo cách này, nó được sản xuất thương mại, bằng cách thêm một lượng dư brom vào dung dịch NaOH. Điều này tạo thành một hỗn hợp bromide / bromine. Sau đó, các sản phẩm thu được phải bay hơi cho đến khi khô và được xử lý bằng carbon để tạo ra phản ứng khử của ion bromate (BrO3-) đến ion bromide (Br-).
Trung hòa
Tương tự, muối vô cơ này cũng có thể được sản xuất thông qua phản ứng trung hòa natri cacbonat (Na2CO3) với axit bromic (HBrO)3), theo cùng một quy trình được mô tả ở trên.
Thông qua tổng hợp, chất này có thể được tạo ra bằng phương pháp phản ứng giữa sắt với brom và nước. Là một sản phẩm của phản ứng này, các loại bromua sắt có nguồn gốc.
Sau đó, loài này hình thành (đại diện là FeBr2/ FeBr3) được hòa tan trong nước và một lượng natri cacbonat nhất định được thêm vào. Cuối cùng, dung dịch được lọc và chuyển qua quy trình bay hơi để cuối cùng thu được natri bromua.
Thuộc tính
- Nó thường được tìm thấy trong trạng thái kết tập rắn, ở dạng bột trắng.
- Nó có cấu trúc tinh thể, với sự sắp xếp phân tử hình khối lập phương tập trung vào các mặt.
- Điểm nóng chảy của chất này là khoảng 747 ° C đối với dạng khan và 36 ° C đối với dạng mất nước, cho thấy sự phân hủy trước khi tan chảy.
- Nó bao gồm một ion natri (Na+) và một ion bromide (Br-), với khối lượng mol hoặc khối lượng phân tử 102,89 g / mol.
- Điểm sôi của nó khá cao, được quan sát ở 1390 ° C (tương đương 2530 ° F hoặc 1660 K).
- Độ hòa tan của loài này là khoảng 94,32 g / 100ml trong nước ở 25 ° C, tăng dần khi nhiệt độ tăng.
- Khi bị nung nóng đến mức phân hủy, chất này sẽ giải phóng khí brom và natri oxit được coi là độc hại.
- Mật độ của dạng khan natri bromua là 3,21 g / cm3, trong khi đó của hợp chất dihydrat là 2,18 g / cm3.
- Độ hòa tan của nó trong rượu được coi là vừa phải, như trong các dung môi khác như pyridine, ammonia và hydrazine.
- Nó có khả năng không hòa tan với acetonitril và acetone.
Công dụng
- Trong lĩnh vực y học, nó được sử dụng như một loại thuốc cho một số lượng lớn các tình trạng gây co giật và như một liệu pháp để ngăn ngừa chứng động kinh ở những bệnh nhân mắc hội chứng Wolf-Hirschhorn, cũng như trong các phương pháp điều trị an thần và thôi miên..
- Trong thú y được sử dụng ở những con chó bị rối loạn co giật do tác dụng phụ của thuốc như phenobarbital hoặc primidone.
- Trong lĩnh vực công nghiệp dầu mỏ, nó được sử dụng trong các quy trình chuẩn bị một số chất lỏng có mật độ khác nhau được sử dụng trong các giếng dầu.
- Trong lĩnh vực nghiên cứu sinh học, tính chất diệt vi sinh của nó đã được chứng minh; nghĩa là, nó được sử dụng để kiểm soát sự phát triển của các loại vi khuẩn khác nhau.
- Trong một số tổng hợp nhất định của loại hữu cơ, muối có tính chất vô cơ này được sử dụng để điều chế các loài khác được cấu thành bởi brom. Ví dụ, bằng phương pháp phản ứng của Finkelstein, người ta thu được một số halogenua có độ phản ứng lớn hơn, một trong số đó được sử dụng khá phổ biến trong nhiếp ảnh.
- Trong lĩnh vực làm sạch và khử trùng, natri bromide được sử dụng kết hợp với clo để vệ sinh khối lượng nước lớn, chẳng hạn như trong bể bơi và bể sục..
Tài liệu tham khảo
- Wikipedia. (s.f.). Natri bromua. Lấy từ en.wikipedia.org
- PubChem. (s.f.). Natri bromua. Lấy từ pubool.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Thư mời Hóa học hữu cơ. Lấy từ sách.google.com.vn
- Khoa học trực tiếp. (s.f.). Natri bromua. Lấy từ scTHERirect.com
- Riviere, J. E. và Papich, M. G. (2009). Dược và Thú y. Lấy từ sách.google.com.vn


