Cấu trúc, tính chất và công dụng của Beryllium hydride (BeH2)
các hydrat berili là một hợp chất cộng hóa trị được hình thành giữa beryllium kim loại kiềm và hydro. Công thức hóa học của nó là BeH2, và là cộng hóa trị, nó không bao gồm Be ion2+ cũng không phải H-. Đó là, cùng với LiH, một trong những hydrua kim loại nhẹ nhất có khả năng tổng hợp.
Nó được sản xuất bằng cách xử lý dimethylberil, Be (CH3)2, với hydrua nhôm lithium, LiAlH4. Tuy nhiên, BeH2 Tinh khiết nhất thu được từ quá trình nhiệt phân di-tert-butylberyllium, Be (C (CH3)3)2 ở 210 ºC.

Là một phân tử riêng lẻ ở trạng thái khí, nó là tuyến tính trong hình học, nhưng ở trạng thái rắn và lỏng, nó trùng hợp trong các mảng của mạng ba chiều. Nó là một chất rắn vô định hình trong điều kiện bình thường, và có thể trở thành tinh thể và thể hiện tính chất kim loại dưới áp lực rất lớn.
Nó đại diện cho một phương pháp lưu trữ hydro có thể, như là một nguồn hydro khi phân hủy, hoặc như một chất khí hấp thụ rắn. Tuy nhiên, BeH2 Nó rất độc hại và gây ô nhiễm do tính chất phân cực cao của berili.
Chỉ số
- 1 Cấu trúc hóa học
- 1.1 Phân tử BeH2
- 1.2 Chuỗi BeH2
- 1.3 Mạng ba chiều của BeH2
- 2 thuộc tính
- 2.1 Ký tự cộng hóa trị
- 2.2 Công thức hóa học
- 2.3 Ngoại hình
- 2.4 Độ hòa tan trong nước
- 2.5 Độ hòa tan
- Mật độ 2,6
- 2.7 Độ phản ứng
- 3 công dụng
- 4 tài liệu tham khảo
Cấu trúc hóa học
Phân tử BeH2
Trong hình ảnh đầu tiên, có thể nhìn thấy một phân tử riêng lẻ của beryllium hydride ở trạng thái khí. Lưu ý rằng hình học của nó là tuyến tính, với các nguyên tử H cách nhau một góc 180 độ. Để giải thích hình học như vậy, nguyên tử Be phải có lai hóa sp.
Beryllium có hai electron hóa trị, nằm trong quỹ đạo 2s. Theo lý thuyết liên kết hóa trị, một trong số các electron của quỹ đạo 2s được thúc đẩy mạnh mẽ lên quỹ đạo 2p; và như một hệ quả, giờ đây nó có thể tạo thành hai liên kết cộng hóa trị với hai quỹ đạo lai sp.
Và những gì về phần còn lại của quỹ đạo tự do của Be? Hai quỹ đạo 2p tinh khiết khác có sẵn, không bị điều chỉnh. Với họ trống rỗng, BeH2 nó là một hợp chất thiếu điện tử ở dạng khí; và do đó, bằng cách làm mát và nhóm các phân tử của chúng, chúng ngưng tụ và kết tinh trong một polymer.
Chuỗi BeH2
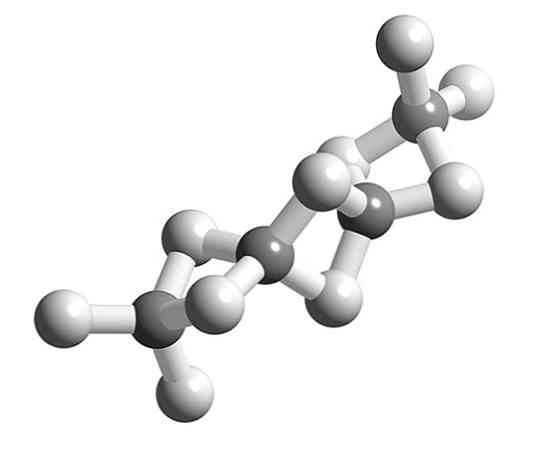
Khi phân tử BeH2 trùng hợp, hình học xung quanh của nguyên tử Be không còn là tuyến tính và trở thành tứ diện.
Trước đây, cấu trúc của polymer này được mô hình hóa như thể chúng là các chuỗi với các đơn vị BeH2 được liên kết bởi các cầu hydro (hình trên cùng, với các hình cầu có tông màu trắng và xám). Không giống như các liên kết hydro của các tương tác lưỡng cực - lưỡng cực, chúng có đặc tính cộng hóa trị.
Trong cầu Be-H-Be của polymer, hai electron được phân phối giữa ba nguyên tử (liên kết 3c, 2e), về mặt lý thuyết phải được định vị nhiều hơn xung quanh nguyên tử hydro (vì nó có độ âm điện cao hơn).
Mặt khác, Be được bao quanh bởi bốn H quản lý để lấp đầy chỗ trống điện tử của nó, hoàn thành quãng tám hóa trị của nó.
Ở đây lý thuyết trái phiếu hóa trị mờ nhạt để đưa ra một lời giải thích tương đối chính xác. Tại sao? Bởi vì hydro chỉ có thể có hai electron và liên kết -H- sẽ có sự tham gia của bốn electron.
Vì vậy, để giải thích các cây cầu Be-H2-Be (hai quả cầu màu xám được liên kết bởi hai quả cầu trắng) cần các mô hình phức tạp khác của liên kết, chẳng hạn như các mô hình được cung cấp bởi lý thuyết quỹ đạo phân tử.
Người ta đã tìm thấy thực nghiệm rằng cấu trúc polyme của BeH2 Nó không thực sự là một chuỗi, mà là một mạng ba chiều.
Mạng ba chiều của BeH2
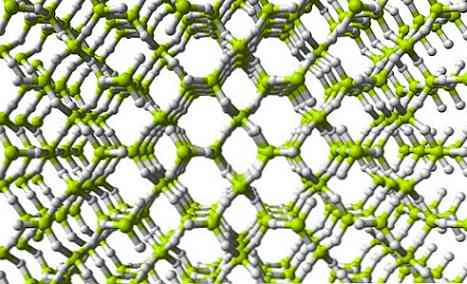
Hình trên cho thấy một phần của mạng BeH ba chiều2. Lưu ý rằng các quả cầu màu xanh lá cây màu vàng, các nguyên tử của Be, tạo thành một khối tứ diện như trong chuỗi; tuy nhiên, trong cấu trúc này có số lượng cầu hydro lớn hơn và ngoài ra, đơn vị cấu trúc không còn là BeH2 nhưng BeH4.
Các đơn vị cấu trúc BeH giống nhau2 và BeH4 họ chỉ ra rằng trong mạng có số lượng lớn hơn các nguyên tử hydro (4 nguyên tử 4 H cho mỗi Be).
Điều này có nghĩa là berili trong mạng này quản lý để lấp chỗ trống điện tử của nó thậm chí nhiều hơn trong cấu trúc polymer giống như chuỗi..
Và như là sự khác biệt rõ ràng nhất của polymer này đối với từng phân tử BeH2, Là Be nhất thiết phải có một lai sp3 (Thông thường) để giải thích các hình học tứ diện và phi tuyến tính.
Thuộc tính
Nhân vật hóa trị
Tại sao beryllium hydride là một hợp chất cộng hóa trị và không ion? Các hydrua của các nguyên tố khác thuộc nhóm 2 (ông Becamgbara) là ion, nghĩa là chúng bao gồm các chất rắn được hình thành bởi một cation M.2+ và hai anion hydrua H- (MgH2, CaH2, BaH2). Do đó, BeH2 Nó không bao gồm Be2+ cũng không phải H- tương tác tĩnh điện.
Cation2+ nó được đặc trưng bởi sức mạnh phân cực cao của nó, làm biến dạng các đám mây điện tử của các nguyên tử xung quanh.
Kết quả của sự biến dạng này, các anion H- họ buộc phải hình thành liên kết cộng hóa trị; các liên kết, là nền tảng của các cấu trúc vừa được giải thích.
Công thức hóa học
BEH2 hoặc (BeH2)
Ngoại hình
Chất rắn vô định hình không màu.
Độ hòa tan trong nước
Nó bị hỏng.
Độ hòa tan
Không hòa tan trong dietyl ete và toluene.
Mật độ
0,65 g / cm3 (1,85 g / L). Giá trị đầu tiên có thể là pha khí và thứ hai là chất rắn polymer.
Khả năng phản ứng
Phản ứng chậm với nước, nhưng bị thủy phân nhanh chóng bởi HCl tạo thành beryllium clorua, BeCl2.
Beryllium hydride phản ứng với các bazơ Lewis, đặc biệt là trimethylamine, N (CH)3)3, để tạo thành một bổ sung dimeric, với hydrides cầu.
Ngoài ra, nó có thể phản ứng với dimethylamine để tạo thành một loại beryllium diamide, [Be (N (CH (CH)3)2)2]3 và hydro. Phản ứng với lithium hydride, trong đó ion H- là cơ sở của Lewis, hình thành LIBeH tuần tự3 và Li2BEH4.
Công dụng
Beryllium hydride có thể là một cách đầy hứa hẹn để lưu trữ hydro phân tử. Bằng cách phân hủy polymer, nó sẽ giải phóng H2, mà sẽ phục vụ như nhiên liệu tên lửa. Từ phương pháp này, mạng ba chiều sẽ lưu trữ nhiều hydro hơn chuỗi.
Ngoài ra, như có thể thấy trong hình ảnh của mạng, có những lỗ chân lông sẽ cho phép lưu trữ các phân tử H.2.
Trên thực tế, một số nghiên cứu mô phỏng việc lưu trữ vật lý sẽ như thế nào trong BeH2 kết tinh đó là, polymer chịu áp lực rất lớn, và tính chất vật lý của nó với lượng hydro bị hấp phụ khác nhau.
Tài liệu tham khảo
- Wikipedia. (2017). Beryllium hydride. Lấy từ: en.wikipedia.org
- Armstrong, D.R., Jamieson, J. & Perkins, P.G. Định lý. Chim. Acta (1979) Các cấu trúc điện tử của polymer beryllium hydride và polymer boron hydride. 51: 163. doi.org/10.1007/BF00554099
- Chương 3: Beryllium Hydride và Oligomers của nó. Lấy từ: shodhganga.inflibnet.ac.in
- Vikas Nayak, Suman Banger và U. P. Verma. (2014). Nghiên cứu về hành vi cấu trúc và điện tử của BeH2 dưới dạng hợp chất lưu trữ hydro: Cách tiếp cận ban đầu. Tài liệu hội thảo về khoa học, tập. 2014, ID bài viết 807893, 5 trang. doi.org/10.1155/2014/807893
- Rùng mình & Atkins. (2008). Hóa vô cơ Trong các yếu tố của nhóm 1. (Ấn bản thứ tư). Đồi Mc Graw.


