Canxi Hydride (CaH2) Tính chất, khả năng phản ứng và công dụng
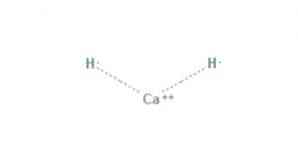
các canxi hydrua là một hợp chất hóa học có công thức CaH2, làm cho nó trở thành hydrua kiềm thổ. Hợp chất hóa học này có hai liên kết ion giữa canxi và hai ion hydride, như trong Hình 1.
Nó là một hydrua muối, có nghĩa là cấu trúc của nó tương tự như muối. Cấu trúc tinh thể của nó giống như cấu trúc của chì clorua (khoáng Cotunnite) như trong Hình 2.

Tất cả các kim loại kiềm và kiềm thổ tạo thành muối hydride. Trong hóa học, hydrua là anion hydro, H- hoặc, thông thường hơn, một hợp chất trong đó một hoặc nhiều trung tâm hydro có tính chất nucleophilic, khử hoặc cơ bản.
Trong các hợp chất được coi là hydrua, nguyên tử hydro được gắn vào một nguyên tố hoặc nhóm có tính điện ly cao hơn.
Nó có thể được sản xuất bằng cách phản ứng canxi và hydro ở nhiệt độ từ 300 đến 400 độ C. Một cách khác để điều chế canxi hydride là làm nóng canxi clorua cùng với kim loại hydro và natri. Phản ứng xảy ra như sau:
CaCl2 + H2 + 2Na → CaH2 + 2NaCl
Trong phản ứng này, canxi (Ca) và hydro (H) tạo ra một phân tử canxi hydride trong khi các nguyên tử natri cùng với clo tạo ra các phân tử natri clorua (NaCl).
Canxi hydride cũng có thể được sản xuất bằng cách giảm canxi oxit (CaO) bằng magiê (Mg). Phản ứng được thực hiện với sự có mặt của hydro. Phản ứng này cũng tạo ra oxit magiê (MgO). Dưới đây là công thức cho phản ứng hóa học này:
CaO + Mg + H2 → CaH2 + MgO
Chỉ số
- 1 Tính chất lý hóa của canxi hydride
- 2 Tính phản ứng và mối nguy hiểm
- 3 Xử lý và lưu trữ
- 4 công dụng và ứng dụng
- 4.1 Chất hút ẩm
- 4.2 Sản xuất hydro
- 4.3 Chất khử
- 5 Bất lợi trong việc sử dụng canxi hydride
- 6 tài liệu tham khảo
Tính chất hóa lý của canxi hydride
Canxi hydride là một tập hợp các tinh thể có cấu trúc chỉnh hình màu trắng khi nó nguyên chất. Nói chung, rất hiếm khi tìm thấy nó ở dạng này vì vậy nó thường có màu xám. Nó thiếu một mùi đặc trưng. Sự xuất hiện của nó được thể hiện trong Hình 3 (Hiệp hội Hóa học Hoàng gia, 2015).

Nó có trọng lượng phân tử 42.094 g / mol, có nhiệt độ nóng chảy 816 độ C và mật độ 1,70 g / ml. Nếu nó hòa tan trong nước, nó sẽ phản ứng dữ dội tạo ra hydro. Nó cũng phản ứng với rượu (Trung tâm thông tin công nghệ sinh học quốc gia., S.F.).
Tính phản ứng và mối nguy hiểm
Canxi hydride là một hóa chất ổn định, mặc dù nó có khả năng phản ứng cao với nước hoặc độ ẩm. Khi tiếp xúc với nước, nó giải phóng các khí hydro dễ cháy có thể tự bốc cháy.
Nó được coi là một hợp chất nổ. Khi đun nóng trong phản ứng với tetrahydrofuran, nó có thể gây nổ. Khi trộn với chlorate, hypochlorite, bromate, kali perchlorate, nó trở nên nhạy cảm với nhiệt, ma sát và trở thành chất nổ (Canxi Hydride 7789-78-8, 2016).
Khi bạc florua được nghiền với canxi hydride, khối lượng sẽ trở nên nóng sáng. Đun nóng mạnh hydrua bằng clo, brom hoặc iốt dẫn đến sự phát sáng.
Hỗn hợp hydrua với các bromat khác nhau, ví dụ bari bromat hoặc clorat, ví dụ bari clorat và perchlorate như kali perchlorate, phát nổ khi triti hóa. CaH2 phản ứng nóng sáng với bạc florua nếu bị ma sát.
Hợp chất này phải được xử lý trong môi trường khí trơ. Nếu không được xử lý đúng cách, nó có thể gây ra mối đe dọa nghiêm trọng đối với sức khỏe và sự an toàn của nhân viên phòng thí nghiệm, nhân viên cứu hộ và người xử lý chất thải hóa học (trung tâm UC về an toàn phòng thí nghiệm, 2013).
Vô cùng nguy hiểm trong trường hợp tiếp xúc với da hoặc mắt, vì nó gây khó chịu. Rất nguy hiểm trong trường hợp tiếp xúc với da vì nó có thể bị ăn mòn.
Nó cũng nguy hiểm trong trường hợp nuốt phải và hít phải. Số lượng tổn thương mô phụ thuộc vào độ dài của tiếp xúc. Tiếp xúc với mắt có thể dẫn đến tổn thương giác mạc hoặc mù.
Tiếp xúc với da có thể gây viêm và phồng rộp. Hít phải bụi sẽ tạo ra sự kích thích đường tiêu hóa hoặc đường hô hấp, đặc trưng là nóng rát, hắt hơi và ho.
Tiếp xúc quá nhiều có thể gây tổn thương phổi, nghẹt thở, bất tỉnh và thậm chí tử vong. Viêm mắt được đặc trưng bởi đỏ, kích ứng và ngứa. Viêm da được đặc trưng bởi ngứa, bong tróc, đỏ hoặc đôi khi phồng rộp.
Tiếp xúc nhiều lần của mắt ở mức độ thấp có thể gây kích ứng mắt. Tiếp xúc nhiều lần với da có thể gây ra sự phá hủy da cục bộ hoặc viêm da.
Hít bụi lặp đi lặp lại có thể tạo ra một mức độ kích thích hô hấp hoặc tổn thương phổi khác nhau. Hít bụi lặp đi lặp lại hoặc kéo dài có thể gây kích ứng đường hô hấp mãn tính (Bảng dữ liệu an toàn vật liệu Canxi hydride MSDS, 2005).
Trong trường hợp tiếp xúc với mắt, chúng cần được rửa ngay lập tức với nhiều nước trong ít nhất 15 phút, thỉnh thoảng nâng mí mắt trên và dưới.
Trong trường hợp tiếp xúc với da, nên rửa sạch ngay lập tức với nhiều nước trong ít nhất 15 phút trong khi cởi bỏ quần áo và giày bị nhiễm bẩn.
Trong trường hợp ăn, không nên gây nôn. Một trung tâm kiểm soát chất độc nên được gọi. Nên rời khỏi khu triển lãm và di chuyển ra ngoài trời ngay lập tức.
Trong trường hợp hít phải, nếu thở khó khăn, cần phải cung cấp oxy. Không nên thở bằng miệng nếu nạn nhân nuốt phải hoặc hít phải chất này.
Hô hấp nhân tạo nên được gây ra với sự trợ giúp của mặt nạ bỏ túi được trang bị van một chiều hoặc thiết bị y tế hô hấp phù hợp khác. Trong mọi trường hợp, phải được chăm sóc y tế ngay lập tức.
Xử lý và lưu trữ
Các hợp chất nên được giữ trong một thùng chứa khô tránh nhiệt. Nó nên được tránh xa các nguồn đánh lửa. Đừng hít bụi. Không nên thêm nước vào sản phẩm này.
Trong trường hợp không đủ thông gió, hãy đeo các thiết bị hô hấp phù hợp như mặt nạ lọc. Trong trường hợp tiếp xúc, bạn nên tìm kiếm sự chăm sóc y tế và hiển thị nhãn càng nhiều càng tốt. Tránh tiếp xúc với da và mắt.
Các vật liệu dễ cháy, nói chung, nên được lưu trữ trong một tủ bảo mật hoặc phòng lưu trữ riêng biệt. Giữ chặt bình chứa.
Giữ ở nơi mát mẻ và thông thoáng. Tất cả các thiết bị chứa vật liệu để tránh tia lửa điện phải được nối đất. Bình chứa phải được giữ khô và ở nơi thoáng mát.
Nó là một vật liệu không bắt lửa. Tuy nhiên, lính cứu hỏa phải mặc thiết bị phù hợp trong khi dập tắt đám cháy xung quanh hợp chất hóa học này.
Không bao giờ nên sử dụng nước để dập tắt đám cháy xung quanh canxi hydride. Cát khô có thể được sử dụng, cũng như các hợp chất như natri clorua và natri cacbonat cho mục đích này.
Để loại bỏ chất thải hydrat canxi, nó phải được phân hủy bằng cách thêm 25 ml metanol cho mỗi gram hydrua trong môi trường nitơ trong khi khuấy.
Sau khi phản ứng kết thúc, cùng một thể tích nước được thêm vào hợp chất canxi methoxide dạng nước và thải vào cống với nhiều nước (Hội đồng nghiên cứu quốc gia, 1995)..
Công dụng và ứng dụng
Chất hút ẩm
Kali hydride là một chất hút ẩm tương đối nhẹ. Vì lý do này, việc sử dụng hợp chất này làm chất hút ẩm sẽ an toàn hơn so với các tác nhân phản ứng hơn, chẳng hạn như hợp kim natri-kali và natri kim loại. Phản ứng với nước theo cách sau:
CaH2 + 2 H2O → Ca (OH) 2 + 2 H2
Các sản phẩm thủy phân của phản ứng này, hydro (khí) và Ca (OH) 2 (hỗn hợp nước), có thể được tách ra khỏi dung môi hóa học sau quá trình lọc, chưng cất hoặc khử màu.
Hợp chất hóa học này là một chất hút ẩm hiệu quả cho nhiều dung môi cơ bản như amin và pyridine. Đôi khi nó được sử dụng để làm khô dung môi trước khi sử dụng chất hút ẩm phản ứng nhiều hơn.
Sản xuất hydro
Vào những năm 1940, hợp chất này đã có sẵn như là một nguồn hydro dưới tên thương mại là "Hydrolith".
Nó đã được sử dụng như một nguồn hydro trong một thời gian dài. Nó vẫn được sử dụng để sản xuất hydro tinh khiết trong các phòng thí nghiệm cho các thí nghiệm khác nhau, pin nhiên liệu tiên tiến và các ứng dụng pin (American Elements, S.F.).
Các hợp chất đã được sử dụng rộng rãi trong nhiều thập kỷ như là một phương tiện thổi phồng thời tiết an toàn và thuận tiện.
Tương tự như vậy, nó thường được sử dụng trong các phòng thí nghiệm để sản xuất một lượng nhỏ hydro tinh khiết cao cho các thí nghiệm. Độ ẩm của nhiên liệu diesel được tính bằng hydro được phát triển sau khi xử lý bằng CaH2.
Chất khử
Khi đun nóng từ 600 đến 1000 độ C, oxit zirconium, niobi, urani, crom, titan, vanadi và tantalum có thể được khử để điều chế bột của các kim loại này, để có thể sử dụng canxi hydrua trong luyện kim bụi.
Phản ứng sau đây minh họa cách thức canxi hydride hoạt động như một chất khử:
TiO + 2CaH2 → CaO + H2 + Ti
Bất lợi trong việc sử dụng canxi hydride
Hợp chất hóa học này thường được lựa chọn là chất làm khô; Tuy nhiên, nó cũng có một số nhược điểm:
-Hoạt động làm khô của hợp chất này là chậm, vì nó không hòa tan trong bất kỳ dung môi nào mà nó không phản ứng dữ dội.
-Hợp chất bột này không tương thích với nhiều dung môi. Phản ứng của bạn với chlorocarbons thậm chí có thể gây nổ.
-Nó không thể được sử dụng để khử các dung môi, vì nó không có khả năng loại bỏ oxy hòa tan.
-Sự khác biệt giữa canxi hydride và canxi hydroxit là khá khó khăn do sự xuất hiện tương tự của nó.
Tài liệu tham khảo
- Yếu tố Mỹ. (S.F.). canxi hydrua. Lấy từ Americanelements.com: Americanelements.com.
- Canxi hydrua 7789-78-8. (2016). Lấy từ chembook.com: chembook.com.
- canxi hydrua. (s.f.). Lấy từ người học hóa học: chemlearner.com.
- Bảng dữ liệu an toàn vật liệu Canxi hydride MSDS. (2005, ngày 10 tháng 10). Lấy từ sciencelab.com: sciencelab.com.
- Trung tâm Thông tin Công nghệ sinh học Quốc gia. (S.F.). Cơ sở dữ liệu hợp chất PubChem; CID = 105052. Lấy từ pubool.ncbi.nlm.nih.gov: pubool.ncbi.nlm.nih.gov.
- hội đồng nghiên cứu quốc gia. (1995). Thực hành thận trọng trong phòng thí nghiệm: Xử lý và thải bỏ hóa chất. Washinton: Báo chí Quốc gia.
- Hội hóa học hoàng gia. (2015). canxi hydride ID 94784. Lấy từ chemspider.com: chemspider.com.
- Trung tâm UC về an toàn trong phòng thí nghiệm. (2013, ngày 18 tháng 1). quy trình vận hành canxi hydride tiêu chuẩn. Lấy từ chemengr.ucsb.edu: chemengr.ucsb.edu.


