Nguyên tử trung tính là gì? (Có ví dụ)
Một nguyên tử trung tính là cái mà thiếu điện tích do sự bù giữa số lượng proton và electron của nó. Cả hai đều là các hạt hạ nguyên tử tích điện.
Các proton được kết tụ bên cạnh neutron và tạo thành hạt nhân; trong khi các electron được khuếch tán bằng cách xác định một đám mây điện tử. Khi số lượng proton trong một nguyên tử, bằng số nguyên tử của nó (Z), bằng với số electron, người ta nói rằng có sự bù giữa các điện tích trong nguyên tử.
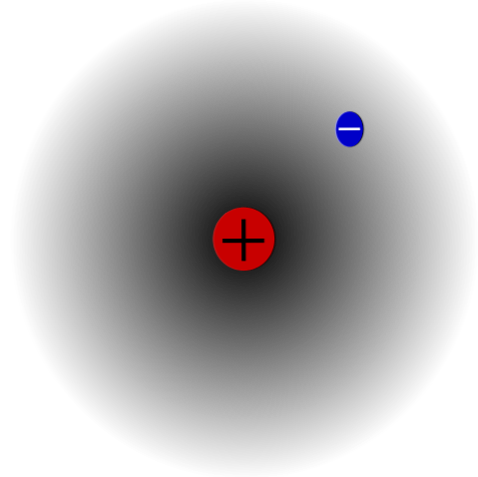
Ví dụ, có một nguyên tử hydro (ảnh trên), có proton và electron. Proton được định vị ở trung tâm của nguyên tử là hạt nhân của nó, trong khi electron quay quanh không gian xung quanh, để lại các vùng có mật độ electron thấp hơn khi nó di chuyển ra khỏi hạt nhân.
Đây là một nguyên tử trung tính vì đúng là Z bằng số electron (1p = 1e). Nếu nguyên tử H bị mất proton đơn lẻ đó, bán kính nguyên tử sẽ co lại và điện tích proton sẽ thắng thế, trở thành cation H.+ (hydron). Mặt khác, nếu nó thu được một electron, sẽ có hai electron và nó sẽ trở thành anion H-- (hydrua).
Chỉ số
- 1 nguyên tử trung tính vs ion
- 1.1 Na vs Na+
- 2 phân tử trung tính
- 3 ví dụ
- 3.1 Oxy
- 3.2 Đồng
- 3.3 Khí quý
- 3.4 Hợp kim kim loại
- 4 tài liệu tham khảo
Nguyên tử trung tính vs ion
Ví dụ về nguyên tử trung tính của H, người ta thấy rằng số lượng proton bằng với số electron (1p = 1e); tình huống không xảy ra với các ion dẫn xuất bởi sự mất hoặc thu được của một điện tử.
Các ion được hình thành do sự thay đổi số lượng electron, do nguyên tử thắng chúng (-) hoặc mất chúng (+).
Trong nguyên tử của cation H+ Điện tích hóa trị của proton đơn độc chiếm ưu thế trước sự vắng mặt hoàn toàn của một electron (1p> 0e). Điều này đúng với tất cả các nguyên tử nặng hơn (np> ne) của bảng tuần hoàn.
Mặc dù sự hiện diện của điện tích dương có vẻ không đáng kể, nhưng nó thay đổi theo đường chéo các đặc điểm của nguyên tố được đề cập.
Mặt khác, trong nguyên tử anion H- Điện tích âm của hai electron chiếm ưu thế trước proton lõi đơn (1p<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Na vs Na+
Một ví dụ được biết đến nhiều hơn là natri kim loại. Nguyên tử trung tính của nó, Na, với Z = 11, có 11 proton; do đó, phải có 11 electron để bù các điện tích dương (11p = 11e).
Natri, là một nguyên tố kim loại, có độ điện ly cao, rất dễ bị mất điện tử; trong trường hợp này, anh ta chỉ mất một, đó là vỏ hóa trị (11p> 10e). Do đó, cation Na được hình thành+, mà tương tác tĩnh điện với anion; như clorua, Cl-, trong muối natri clorua, NaCl.
Natri kim loại là độc và ăn mòn, trong khi cation của nó thậm chí còn hiện diện bên trong các tế bào. Điều này cho thấy các thuộc tính của một nguyên tố có thể thay đổi mạnh mẽ như thế nào khi nó tăng hoặc giảm electron.
Mặt khác, anion Na- (soduro, theo giả thuyết) không tồn tại; và để có thể hình thành, nó sẽ cực kỳ phản ứng, vì nó chống lại bản chất hóa học của natri để thu được điện tử. Na- sẽ có 12 electron, vượt qua điện tích dương của hạt nhân của nó (11p<12e).
Phân tử trung tính
Các nguyên tử được liên kết cộng hóa trị để tạo ra các phân tử, cũng có thể được gọi là các hợp chất. Không thể có các ion bị cô lập trong một phân tử; thay vào đó, có những nguyên tử có điện tích chính thức dương hoặc âm. Các nguyên tử tích điện này ảnh hưởng đến điện tích ròng của phân tử, biến nó thành ion đa nguyên tử.
Để một phân tử là trung tính, tổng các điện tích chính thức của các nguyên tử của nó phải bằng 0; hoặc, đơn giản hơn, tất cả các nguyên tử của nó là trung tính. Nếu các nguyên tử tạo nên một phân tử là trung tính, thì điều này cũng sẽ là.
Ví dụ, bạn có phân tử nước, H2O. Hai nguyên tử H của nó là trung tính, giống như nguyên tử oxy. Chúng không thể được biểu diễn theo cùng một cách như trong hình ảnh của nguyên tử hydro; vì, mặc dù lõi không thay đổi, đám mây điện tử cũng vậy.
Các ion hydronium, H3Ôi+, mặt khác, nó có một nguyên tử oxy với điện tích dương một phần. Điều này có nghĩa là trong ion đa nguyên tử đó, nó bị mất một electron, và do đó số lượng proton của nó lớn hơn số electron của nó.
Ví dụ
Oxy
Nguyên tử oxy trung tính có 8 proton và 8 electron. Khi nó thu được hai electron, nó tạo thành cái được gọi là oxit anion, HOẶC2-. Trong đó, các điện tích âm chiếm ưu thế, có thừa hai electron (8p<10e).
Các nguyên tử oxy trung tính có xu hướng phản ứng và liên kết với nhau cao để tạo thành O2. Đó là vì lý do đó mà không có nguyên tử hoặc "lỏng lẻo" ở đó với số phận của họ và không có phản ứng với bất cứ điều gì. Tất cả các phản ứng đã biết đối với khí này được quy cho oxy phân tử, HOẶC2.
Đồng
Đồng có 29 proton và 29 electron (ngoài neutron). Không giống như oxy, các nguyên tử trung tính của nó có thể được tìm thấy trong tự nhiên do liên kết kim loại và tính ổn định tương đối của chúng.
Giống như natri, nó có xu hướng mất electron thay vì chiến thắng chúng. Với cấu hình điện tử và các khía cạnh khác, nó có thể mất một hoặc hai electron, trở thành cation dạng cốc, Cu+, hoặc cupric, Cu2+, tương ứng.
Cation Cu+ có ít electron hơn (29p<28e), y el Cu2+ đã mất hai điện tử (29p<27e).
Khí quý
Các khí hiếm (He, Ne, Ar, Kr, Xe, Rn), là một trong số ít các nguyên tố tồn tại dưới dạng các nguyên tử trung tính của chúng. Số nguyên tử của chúng lần lượt là: 2, 10, 18, 36, 54 và 86. Họ không được hoặc mất điện tử; mặc dù, Xenon, Xe, có thể tạo thành các hợp chất với flo và mất electron.
Hợp kim kim loại
Kim loại, nếu được bảo vệ khỏi sự ăn mòn, có thể giữ các nguyên tử trung tính của chúng, được liên kết bởi các liên kết kim loại. Trong hợp kim, dung dịch rắn của kim loại, các nguyên tử vẫn (hầu hết) trung tính. Ví dụ, trong đồng thau, có các nguyên tử trung tính của Cu và Zn.
Tài liệu tham khảo
- Máy bay phản lực Carasco. (2016). Nguyên tử trung tính là gì? Lấy từ: giới thiệu-to-physics.com
- Đánh dấu, Samuel. (Ngày 25 tháng 4 năm 2017). Ví dụ nguyên tử không trung tính. Kinh dị. Lấy từ: sciences.com
- Hóa chất4. (2018). Nhìn vào các ion. Lấy từ: chem4kids.com
- Whites, Davis, Peck & Stanley. (2008). Hóa học (Tái bản lần thứ 8). Học tập.
- Rùng mình & Atkins. (2008). Hóa vô cơ (Ấn bản thứ tư). Đồi Mc Graw.


