Tính chất, rủi ro và công dụng của sắt sunfua (II)
các sunfua sắt (II), còn được gọi là sắt sunfua, là một hợp chất hóa học có công thức FeS. Bột sắt sunfua là pyrophoric (nó tự bốc cháy trong không khí).
Sắt sunfua (II) thu được bằng cách đun nóng lưu huỳnh và sắt theo phản ứng:
Fe + S → FeS
Phản ứng rất tỏa nhiệt (giải phóng nhiệt) và tỷ lệ giữa sắt và lưu huỳnh phải là 7: 4 (NileRed, 2014).
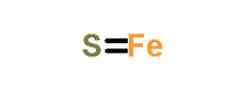
Ferpy sulfide cũng có thể thu được trong môi trường nước bằng cách hòa tan lưu huỳnh trong dung dịch ion sắt (II). Lưu huỳnh, khi hòa tan, tạo thành hydro sunfua phản ứng thuận nghịch với các ion sắt (II) theo phản ứng
Đức tin2+ + H2S FeS (2) + 2H+
Tuy nhiên, phản ứng này cạnh tranh với phản ứng tạo thành axit sunfat sắt (II) theo cách sau:
Đức tin2+ + 2HS- → Fe (HS)2(s)
Sau đó, sắt sunfat sắt (II) bị phân hủy thành sắt sunfat, mặc dù phản ứng xảy ra rất chậm (Rickard, 1995).
Chỉ số
- 1 Tính chất lý hóa
- 2 Tính phản ứng và mối nguy hiểm
- 3 Xử lý và lưu trữ
- 4 công dụng
- 5 tài liệu tham khảo
Tính chất hóa lý
Sắt (II) sunfua là chất rắn màu nâu sẫm hoặc đen. Khi nó nguyên chất, nó không màu (Trung tâm Thông tin Công nghệ sinh học Quốc gia, S.F.). Hình 2 minh họa sự xuất hiện của sắt sunfua.

Hợp chất có trọng lượng phân tử 87,910 g / mol và mật độ 4,84 g / ml. Nó có nhiệt độ nóng chảy 1195 ° C và không tan trong nước và axit nitric (Hiệp hội hóa học Hoàng gia, 2015).
Ferpy sulfide phản ứng trong môi trường axit tạo thành hơi oxit sắt và hydro sunfua cực độc. Điều này được quan sát trong các phản ứng sau:
FeS + 2H+ → Niềm tin2+ + H2S
Phản ứng với các dung dịch axit sunfuric loãng để tạo thành oxit sắt, lưu huỳnh đioxit và nước theo phản ứng:
FeS + H2VẬY4 → FeO + H2O + SO2
Tính phản ứng và mối nguy hiểm
Ferpy sulfide là một hợp chất không ổn định và phản ứng với không khí để tạo thành oxit sắt và lưu huỳnh. Hợp chất này là pyrophoric và có thể tự bốc cháy hoặc cũng là sản phẩm của một tác động mạnh, vì vậy không nên nghiền nó trong vữa khi nó được tổng hợp và phải được xử lý cẩn thận.
Phản ứng với các tác nhân oxy hóa và khi phân hủy nóng phát ra hơi độc của oxit lưu huỳnh. Hợp chất này rất nguy hiểm trong trường hợp nuốt phải và nguy hiểm trong trường hợp tiếp xúc với mắt (chất kích thích) và đường hô hấp (Bảng dữ liệu an toàn vật liệu Ferpy sulfide, 2013).
Trong trường hợp tiếp xúc với mắt, những thứ này nên được rửa sạch với nhiều nước trong ít nhất 15 phút, thỉnh thoảng nâng mí mắt trên và dưới.
Nếu hợp chất tiếp xúc với da, cần rửa sạch với nhiều nước trong ít nhất 15 phút trong khi cởi bỏ quần áo và giày bị nhiễm bẩn..
Trong trường hợp nuốt phải, nếu nạn nhân tỉnh táo và tỉnh táo, anh ta nên được cho uống 2-4 cốc sữa hoặc nước. Không bao giờ đưa bất cứ thứ gì bằng miệng cho một người bất tỉnh
Trong trường hợp hít phải, nạn nhân nên được đưa ra khỏi nơi tiếp xúc và di chuyển đến nơi mát mẻ. Nếu nó không thở, nên hô hấp nhân tạo. Nếu thở khó khăn, nên thở oxy.
Trong mọi trường hợp, phải có sự chăm sóc y tế ngay lập tức (ngư khoa, 2009).
Sắt sulfide có liên quan đến một tình trạng lành tính hiếm gặp được gọi là pseudomelanosis duodeni. Biểu hiện này qua nội soi là các đốm màu nâu, rời rạc, rời rạc ở niêm mạc tá tràng.
Nó không tạo ra các triệu chứng và có thể đảo ngược. Với kính hiển vi điện tử và phân tích tia X phân tán năng lượng bằng đầu dò điện tử, sắc tố tương ứng chủ yếu với sự tích lũy của sunfua sắt (FeS) trong các đại thực bào trong propria lamina (Cheng CL, 2000).
Xử lý và lưu trữ
Ferric sulfide nên tránh xa nhiệt và nguồn bắt lửa. Container rỗng đại diện cho nguy cơ hỏa hoạn, chất thải phải được bốc hơi dưới mui xe vắt. Nối đất tất cả các thiết bị chứa vật liệu để tránh tia lửa điện.
Đừng hít bụi. Tránh tiếp xúc với mắt. Mặc quần áo bảo hộ phù hợp. Trong trường hợp không đủ thông gió, mặc thiết bị hô hấp phù hợp.
Nếu bạn cảm thấy không khỏe, bạn nên tìm kiếm sự chăm sóc y tế và hiển thị nhãn sản phẩm càng nhiều càng tốt. Các hợp chất nên tránh xa các chất không tương thích như các tác nhân oxy hóa và axit.
Bình chứa hợp chất nên được giữ khô ở nơi thoáng mát. Và nó phải được đóng kín ở nơi thoáng khí. Vật liệu dễ cháy nên được bảo quản tránh nhiệt độ cao và tránh xa các tác nhân oxy hóa mạnh.
Công dụng
Sắt sunfua được sử dụng trong các ngành công nghiệp hợp kim và thép không gỉ để kiểm soát sự hấp thụ của hydro. Ngành công nghiệp sắt thép sử dụng sắt sunfua làm chất tái sunfua hóa trong sản xuất thép không gỉ, hợp kim và thép không gỉ.
Nó cũng hoạt động như một tác nhân xuống cấp để cải thiện công suất của máy đúc thép, được sử dụng trong sản xuất các bộ phận thép khác nhau. Trong quá trình tinh chế axit photphoric thô, sắt sunfua được sử dụng làm chất khử để loại bỏ các tạp chất nặng từ axit photphoric.
Một ứng dụng khác của sắt sunfua là trong sản xuất sắt dễ uốn. Sắt sunfua kết hợp với silic sắt và ferromanganese được sử dụng để tăng hàm lượng lưu huỳnh của thép và sắt.
Sắt sunfua cũng được sử dụng làm hóa chất trong phòng thí nghiệm để điều chế khí hydro sunfua. Trong thuốc nhuộm tóc, sơn, gốm sứ, chai và kính, sắt sunfua được sử dụng làm sắc tố. Nó cũng được sử dụng trong chất bôi trơn và xử lý khí thải.
Sắt sunfua có công dụng tương thích với sunfat. Các hợp chất sunfat hòa tan trong nước và được sử dụng trong xử lý nước. Sắt sunfua cũng được sử dụng trong sản xuất vật đúc kim loại.
Sắt sunfua là pyrite khoáng sản giống như vàng và được mệnh danh là "vàng của kẻ ngốc". Pyrite được sử dụng trong sản xuất lưu huỳnh và axit sulfuric và cũng được sử dụng trong khai thác than (JAINSON LABS (INDIA), S.F.).
Tài liệu tham khảo
- Cheng CL, e. a. (2000). Pseudomelanosis duodeni: báo cáo trường hợp. Changgeng Yi Xue Za Zhi 23 (6), 372-376.
- khoa học đánh cá (2009, ngày 20 tháng 8). Bảng dữ liệu an toàn vật liệu Sắt (II) Sulfide. Lấy từ lasecsa.
- JAINSON LABS (ẤN ĐỘ). (S.F.). Công dụng của Ferpy Sulphide. Lấy từ jainsonfes.
- Bảng dữ liệu an toàn vật liệu Ferric sulfide. (2013, ngày 21 tháng 5). Lấy từ sciencelab.
- Trung tâm Thông tin Công nghệ sinh học Quốc gia. (S.F.). Cơ sở dữ liệu hợp chất PubChem; CID = 14828. Lấy từ PubChem.
- (2014, ngày 15 tháng 5). Chuẩn bị sắt (II) Sulfide (phản ứng nguội). Lấy từ youtube.
- Rickard, D. (1995). Động học của kết tủa FeS: Phần 1. Cơ chế phản ứng cạnh tranh. Geochimica et Cosmochimica Acta Tập 59, Số 21, 4367-4379.
- Hội hóa học hoàng gia. (2015). Sắt (II) sunfua. Lấy từ chemspider: chemspider.com.


