Cấu trúc, tính chất và công dụng của Mangan Oxide (MnO2)
các oxit mangan (MnO2) là một hợp chất hóa học vô cơ được hình thành bởi nguyên tố mangan có số oxi hóa +4 và oxy, trong quá trình hình thành các oxit có số oxi hóa là -2. Nó cũng được biết đến với tên của oxit mangan (IV) và anhydride mangan.
Nó là một chất rắn từ cà phê tối đến đen. Đó là trong tự nhiên như các khoáng vật pirolusite, màu đen và kết tinh hình thành sợi nhánh (kéo dài phân nhánh). Nó có thể thu được dưới dạng dư lượng màu đen trong phản ứng giữa ethylene và kali permanganat sau khi tạo thành glycol do tác dụng oxy hóa của kali permanganat.

Nó rất quan trọng trong ngành thủy tinh do đặc tính của tác nhân oxy hóa, vì nó loại bỏ màu xanh lá cây đến từ các hợp chất màu và chuyển chúng thành màu.
Chỉ số
- 1 Cấu trúc hóa học
- 2 thuộc tính
- 3 công dụng
- 3.1 Làm chất xúc tác
- 4 Ảnh hưởng đến sức khỏe
- 5 tài liệu tham khảo
Cấu trúc hóa học
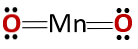
Cấu trúc hóa học của hợp chất tương ứng với cấu trúc của anhydride chứ không phải của oxit cơ bản, như mong đợi vì nó bao gồm kim loại và phi kim loại.
Trường hợp đặc biệt này là do hành vi của mangan trong các trạng thái oxy hóa khác nhau mà nó có. Do đó, đối với các trạng thái oxi hóa +2 và +3 tạo thành các oxit MnO và Mn2Ôi3 tương ứng, khi phản ứng với nước, chúng tạo thành hydroxit mangan và hydroxit mangan tương ứng.
Tuy nhiên, Mn2Ôi3 trong môi trường hơi axit nó hoạt động như một anhydride. Với các trạng thái oxy hóa +4, +6 và +7, MnO2, MnO3 và MnO4 chúng tạo thành axit khi phản ứng với nước.
Trong môi trường hơi axit MnO2 nó hoạt động như một oxit cơ bản, vì vậy nó có thể tạo thành hydroxit tương ứng.

Cần phải lưu ý rằng trong trường hợp này không có đề cập đến tính chất lưỡng tính, theo đó một hợp chất có thể hoạt động như một axit hoặc như một bazơ. Đây là trường hợp đặc biệt của hành vi Mn.
Thuộc tính
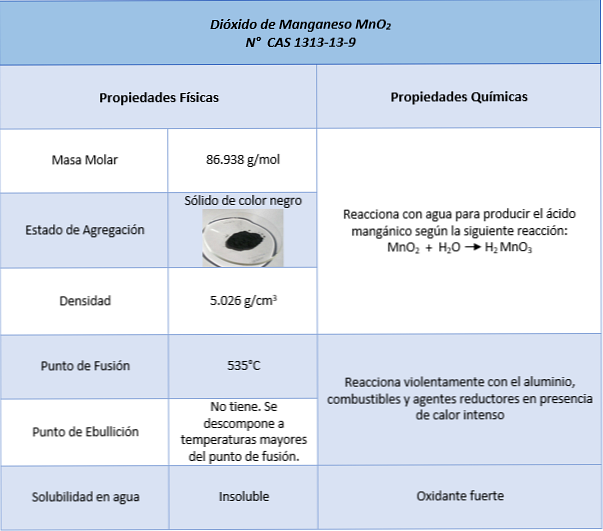
Công dụng
- Nó được sử dụng như một nguồn mangan
- Là một chất oxy hóa trong pin kiềm
- Sơn cho thủy tinh, gốm sứ.
- Trong việc thu được clo và iốt.
- Trong sự phân hủy hydro peroxide cho sự hình thành oxy và nước khí.
- Trong phản ứng phân hủy kali clorat để sản xuất oxy khí và kali clorua.
- Hòa tan trong acetone hoặc trong dichloromethane, oxy hóa các rượu bậc nhất thành aldehyd và thứ cấp thành ketone.
- Sản xuất pin kiềm.
Làm chất xúc tác
Điều này áp dụng cho các phản ứng khử oxit, để loại bỏ các sunfua như H2S và cation như Fe+2 và Mn+2 , Asen và radio được tìm thấy trong nước ngầm bị ô nhiễm bởi loại hợp chất này.
Sự ô nhiễm này có thể được tạo ra do đổ chất thải độc hại không được kiểm soát, bằng cách rửa đất bị ô nhiễm hoặc bởi sự có mặt của các nguyên tố hóa học tại thời điểm khai thác nước.
MnO2 Độ tinh khiết cao thu được từ pyrolusite được sử dụng làm bộ lọc (Filox) là phương tiện hiệu quả nhất để loại bỏ lớp tạp chất này khỏi nước ngầm.
Ảnh hưởng đến sức khỏe
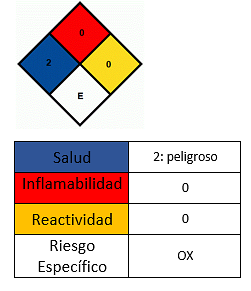
- Tránh tiếp xúc với da.
- Trong trường hợp tiếp xúc, rửa khu vực tương ứng.
- Không hít bột.
- Kích ứng và đỏ có thể được nhìn thấy khi giao tiếp bằng mắt. Rửa với nhiều nước, để nước chảy qua mắt và gọi trợ giúp y tế trong trường hợp nghiêm trọng.
- Tiếp xúc với các kích ứng da và đỏ được quan sát. Rửa vùng bị ảnh hưởng bằng nhiều nước và xà phòng.
- Tiếp xúc với da kéo dài sẽ loại bỏ chất béo tự nhiên của bạn, gây ra viêm da.
- Hít phải có thể gây ra tình trạng giống như cúm (khói kim loại). Tình trạng này được đặc trưng bởi sốt cao, ớn lạnh, khô miệng và cổ họng, đau cơ và đau đầu.
- Nó có thể gây kích ứng đường hô hấp và tăng tỷ lệ nhiễm trùng đường hô hấp (viêm phổi). Nhiễm độc bằng cách hấp thụ muối mangan vô cơ qua phổi là không thể, nhưng ngộ độc mãn tính có thể xảy ra.
- Phơi nhiễm mãn tính với bụi hoặc khói từ mangan dioxide trong một thời gian dài có thể ảnh hưởng đến hệ thần kinh trung ương và dẫn đến sự phát triển của bệnh Parkinson, khó đi lại, co thắt cơ và thay đổi hành vi.
- Ăn vào có thể gây đau bụng và buồn nôn.
- Nó không dễ cháy, nhưng nó giúp truyền lửa trong các vật liệu sợi đốt. Nếu đun nóng đến nhiệt độ trên 535 ° C, chất sẽ phân hủy thành oxit mangan (III) Mn2Ôi3 và oxy, dễ cháy và làm tăng nguy cơ hỏa hoạn. Trong trường hợp này, đám cháy nên được dập tắt bằng bọt hoặc carbon dioxide.
- Trong trường hợp bị đổ, không được thao tác các hợp chất mà không có sự bảo vệ cá nhân đúng cách.
- Lưu trữ hợp chất trong các thùng chứa kín, ở nơi khô và lạnh và tránh xa các chất không tương thích như vật liệu hữu cơ và vật liệu dễ cháy.
- Nơi lưu trữ phải khô ráo và có sàn chống ăn mòn axit và thoát nước tốt..
- Thiết bị bảo vệ cá nhân nên được sử dụng, như găng tay, kính bảo hộ, mặt nạ lọc hơi, bụi và khói.
Tài liệu tham khảo
- B, (2015), Mangan Dioxide, Hiệp hội hóa học hoàng gia - thế giới hóa học, lấy từ chemworld.com
- Karal, (2014), Mangneso Dioxide, Bảng dữ liệu an toàn, được phục hồi từ, karal.com.mx
- Giáo viên ảo của bạn (2015 / 02-25). Các hợp chất vô cơ mangan (trường hợp đặc biệt 1) - Bài học lý thuyết), lấy từ youtube.com
- Ecured, (s.f), Mangan Dioxide, được thu hồi từ ecured.cu
- Angarita G, Johnny., (2017), Mangan Dioxide: Một công nghệ đặc biệt. Hydrotec, được phục hồi từ hydrotecoc.com
- Fernández, G., (2015), MnO Mangan Dioxide2/ acetone, Hóa hữu cơ, Phục hồi từ quimicaorganica.net
- Tronox, (2011), Mangan Dioxide, Bảng dữ liệu an toàn, được phục hồi từ, tronox.com


