Bào tử nền tảng, kỹ thuật và sử dụng
các nhuộm bào tử là phương pháp được sử dụng để tô màu các cấu trúc kháng thuốc hình thành một số chi vi khuẩn khi chúng ở trong điều kiện không thuận lợi; những cấu trúc này tương ứng với một cách sống.
Có nhiều chi tạo thành bào tử; tuy nhiên, những thứ chính là Bacillus và Clostridium. Những chi này được coi là phù hợp hơn vì chúng có các loài gây bệnh cho người.
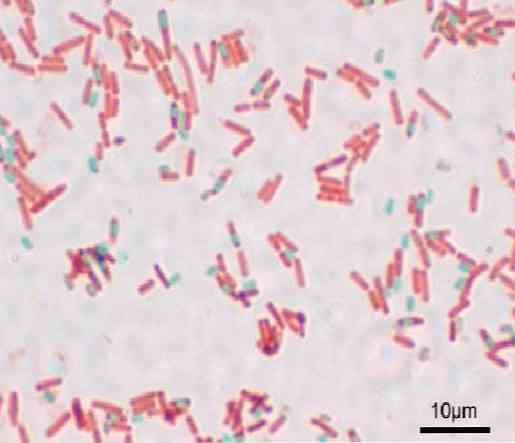
Mỗi trực khuẩn có thể tạo ra một bào tử. Tại thời điểm nhuộm chuẩn bị, bào tử có thể được tìm thấy bên trong trực khuẩn (endospore) hoặc bên ngoài nó (exospore). Với các kỹ thuật nhuộm thông thường cho vi khuẩn - như nhuộm Gram - các bào tử vẫn không màu.
Hiện nay, có một số phương pháp tô màu có thể vượt qua cấu trúc dày của bào tử để nhuộm nó. Những phương pháp này rất đa dạng; Trong số này, chúng ta có thể kể đến kỹ thuật Dorner, vết Möeller và phương pháp Shaeffer-Fulton, còn được gọi là Wirtz-Conklin..
Trong tất cả các kỹ thuật được đề cập, phương pháp Shaeffer-Fulton được sử dụng nhiều nhất trong các phòng thí nghiệm thông thường. Nó nợ tên của hai nhà vi trùng học đã tạo ra màu sắc vào năm 1930: Alicia Shaeffer và MacDonald Fulton. Tuy nhiên, đôi khi kỹ thuật này được gọi là Wirtz-Conklin để vinh danh hai nhà vi khuẩn học của những năm 1900.
Chỉ số
- 1 nền tảng
- 2 kỹ thuật tạo màu bào tử
- 2.1 Kỹ thuật của Dorner
- 2.2 Kỹ thuật sửa góc
- 2.3 Kỹ thuật của Shaeffer-Fulton hoặc Wirtz-Conklin
- 2.4 Kỹ thuật người bán hàng
- 2.5 Kỹ thuật Möeller được sửa đổi mà không cần nhiệt
- 3 công dụng
- 3.1 Ví dụ
- 4 tài liệu tham khảo
Nền tảng
Các bào tử không nhuộm màu với màu thông thường vì chúng có một bức tường rất dày. Thành phần phức tạp của bào tử ngăn cản sự xâm nhập của hầu hết các thuốc nhuộm.
Nếu các bào tử được nghiên cứu từ bên ngoài vào bên trong, các lớp sau được quan sát thấy: đầu tiên, exosporium, là lớp ngoài mỏng nhất được hình thành bởi glycoprotein..
Sau đó đến lớp biểu bì, cung cấp khả năng chống chịu với nhiệt độ cao, tiếp theo là vỏ bao gồm peptidoglycan. Sau đó, có bức tường của cơ sở bảo vệ protoplast.
Bào tử là một cấu trúc mất nước có chứa 15% canxi và axit dipicolinic. Do đó, hầu hết các kỹ thuật tạo màu bào tử đều dựa trên ứng dụng nhiệt để thuốc nhuộm có thể xuyên qua cấu trúc dày.
Một khi bào tử được nhuộm, nó không thể loại bỏ thuốc nhuộm. Trong kỹ thuật Shaeffer-Fulton, màu xanh lá cây malachite xâm nhập vào các tế bào sinh dưỡng và sau khi sử dụng nhiệt, xâm nhập vào nội nhũ và cả exospores.
Khi rửa bằng nước, thuốc nhuộm được loại bỏ khỏi tế bào sinh dưỡng. Điều này xảy ra vì thuốc nhuộm malachite màu xanh lá cây hơi cơ bản, vì vậy nó liên kết yếu với tế bào sinh dưỡng.
Mặt khác, nó không thể thoát ra khỏi bào tử và cuối cùng trực khuẩn với safranin là tương phản. Nền tảng này có giá trị cho phần còn lại của các kỹ thuật, trong đó một cái gì đó tương tự xảy ra.
Kỹ thuật tạo màu bào tử
Để làm cho các bào tử nhuộm màu, bạn phải có một nền văn hóa thuần túy của chủng nghi ngờ mà bạn muốn nghiên cứu.
Nuôi cấy phải chịu nhiệt độ cực cao trong 24 giờ để kích thích vi sinh vật sinh sôi. Đối với điều này, văn hóa có thể được đặt trong lò nướng ở 44 ° C hoặc trong tủ lạnh (8 ° C) trong 24 hoặc 48 giờ.
Nếu quá nhiều thời gian còn lại ở nhiệt độ được đề cập, chỉ quan sát được exospores, vì tất cả các endospores sẽ rời khỏi trực khuẩn.
Vào cuối thời gian, một vài giọt dung dịch sinh lý vô trùng nên được đặt trên một phiến sạch. Sau đó, một phần nhỏ của cây trồng được thực hiện và một sự lây lan tốt được thực hiện.
Sau đó, nó được để khô, nó được cố định với nhiệt và nó được nhuộm bằng một số kỹ thuật được giải thích dưới đây:
Kỹ thuật của Dorner
1- Chuẩn bị trong ống nghiệm một huyền phù tập trung của vi sinh vật được tạo bào tử trong nước cất và thêm một thể tích tương đương của Kinyoun phenolic fuchsin được lọc.
2- Đặt ống vào bồn tắm với nước sôi trong 5 đến 10 phút.
3- Trên một phiến sạch, trộn một giọt huyền phù trước đó với một giọt dung dịch nước nigrosine 10%, đun sôi và lọc.
4- Kéo dài và làm khô nhanh với nhiệt độ nhẹ.
5- Kiểm tra với mục tiêu 100X (ngâm).
Các bào tử nhuộm màu đỏ và các tế bào vi khuẩn dường như không màu trên nền màu xám đen.
Kỹ thuật sửa đổi góc
1- Một huyền phù của vi sinh vật được tạo bào tử được lan truyền trên một phiến kính và cố định với nhiệt.
2- Mẫu được phủ một dải giấy lọc được thêm axit fenic fuchsin. Thuốc nhuộm được làm nóng trong 5 đến 7 phút với ngọn lửa của đầu đốt Bunsen cho đến khi giải phóng hơi. Sau đó, giấy được gỡ bỏ.
3- Rửa chuẩn bị bằng nước và sau đó lau khô bằng giấy thấm.
4 - Phủ lên vết bẩn bằng một màng mỏng 10% nigrosin, sử dụng slide thứ hai để truyền nigrosin hoặc kim.
Màu sắc được lấy bởi bào tử và vi khuẩn giống như mô tả trong nghệ thuật trước đó.
Kỹ thuật Shaeffer-Fulton hoặc Wirtz-Conklin
1- Tạo một trải mỏng với huyền phù của vi sinh vật được bào tử trên một phiến kính và cố định nó để sưởi ấm.
2- Đậy nắp trượt bằng dung dịch nước 5% malachite màu xanh lá cây (có thể đặt giấy lọc trên tờ giấy).
3- Đun nóng trên ngọn lửa của đầu đốt Bunsen để hơi nước thoát ra và loại bỏ ngọn lửa. Lặp lại thao tác trong 6 đến 10 phút. Nếu trong quy trình, dung dịch xanh malachite bay hơi quá nhiều, có thể thêm nhiều hơn nữa.
4- Tháo giấy lọc (nếu đã đặt) và rửa bằng nước.
5- Đắp nắp trượt bằng 0,5% dung dịch safranin trong 30 giây (một số biến thể của kỹ thuật sử dụng 0,1% dung dịch safranin và để yên trong 3 phút).
Với kỹ thuật này, bào tử có màu xanh và trực khuẩn có màu đỏ.
Nó có nhược điểm là endospores của các nền văn hóa trẻ không nhuộm màu tốt, vì chúng trông cực kỳ rõ ràng hoặc không màu. Để tránh điều này, nên sử dụng nuôi cấy 48 giờ ủ.
Kỹ thuật người bán
1- Che vết bẩn bằng chloroform trong 2 phút.
2- Loại bỏ chloroform.
3- Đậy nắp bằng axit cromic 5% trong 5 phút.
4 - Rửa bằng nước cất
5- Tấm được phủ bằng cá chép fuchsin-phenolic và tiếp xúc với ngọn lửa của đầu đốt Bunsen cho đến khi phát ra hơi; sau đó nó được lấy ra khỏi ngọn lửa trong giây lát. Thao tác được lặp lại cho đến khi đạt được 10 phút.
6- Rửa bằng nước.
7- Sử dụng ethanol đã được axit hóa (rượu hydrochloric) để khử màu. Nó được để lại trong 20 hoặc 30 giây.
8- Rửa bằng nước cất.
9- Phản ứng phủ lên tấm bằng xanh methylen trong 5 phút.
10- Rửa bằng nước cất.
11- Nó được để khô và mẫu được lấy dưới kính hiển vi.
Bào tử trông trực khuẩn đỏ và xanh. Điều quan trọng là không hít phải hơi, vì chúng độc hại và về lâu dài chúng có thể gây ung thư.
Kỹ thuật Möeller được sửa đổi mà không cần nhiệt
Năm 2007 Hayama và các cộng tác viên của mình đã tạo ra một bản sửa đổi của kỹ thuật Möeller. Họ đã loại bỏ bước gia nhiệt của thuốc nhuộm và thay thế bằng việc thêm 2 giọt chất hoạt động bề mặt Tergitol 7 cho mỗi 10 ml dung dịch carbolic fuchsin-phenolic. Kết quả tương tự đã thu được.
Công dụng
Màu sắc bào tử cung cấp một thông tin rất có giá trị và hữu ích để xác định mầm bệnh, vì sự hiện diện của cùng, hình dạng, vị trí của nó trong trực khuẩn và khả năng làm biến dạng tế bào sinh dưỡng hay không, là dữ liệu có thể hướng dẫn loài. tham gia vào một giới tính nhất định.
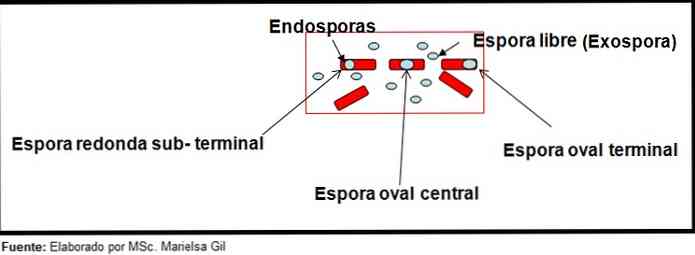
Trong bối cảnh này, điều đáng nói là các bào tử có thể hình tròn hoặc hình bầu dục, chúng có thể nằm ở trung tâm hoặc cũng ở vị trí cận, dưới da hoặc đầu cuối.
Ví dụ
- Clostridium difficile tạo thành một bào tử hình bầu dục ở vị trí cuối làm biến dạng trực khuẩn.
- Bào tử của Clostridium tertium Nó là hình bầu dục, không làm biến dạng trực khuẩn và nằm ở cấp độ cuối.
- Nội tiết của Clostridium tetani nó là thiết bị đầu cuối và làm biến dạng trực khuẩn, tạo ra sự xuất hiện của dùi trống.
- Các bào tử của Clostridium botulinum, C. histolyticum, C. tiểu thuyết và C. vách ngăn chúng có hình bầu dục tròn hoặc dưới lưỡi và làm biến dạng trực khuẩn.
- Nội tiết của Clostridium sordelli Nó nằm ở vị trí trung tâm, với một biến dạng nhẹ.

Tài liệu tham khảo
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Đề xuất một kỹ thuật đơn giản hóa để nhuộm bào tử vi khuẩn mà không áp dụng phương pháp biến đổi thành công nhiệt của phương pháp Moeller. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Wikipedia đóng góp. Vết bẩn Moeller. Wikipedia, bách khoa toàn thư miễn phí. Ngày 3 tháng 11 năm 2018, 03:28 UTC. Có sẵn tại: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Hướng dẫn thí nghiệm kỹ thuật vi sinh. Khoa Khoa học cơ bản Học viện Vi sinh. Học viện bách khoa quốc gia.
- "Nội tiết." Wikipedia, bách khoa toàn thư miễn phí. Ngày 25 tháng 2 năm 2018, 10:20 UTC. 10 tháng 1 năm 2019, 02:42: vi.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J và cộng tác viên. (2006). Nhân viên Lao động của Cộng đồng tự trị Extremadura. Chương trình nghị sự cụ thể Tập IV. Biên tập MAD. Seville-Tây Ban Nha, trang 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006). Kỹ thuật viên phòng thí nghiệm chuyên gia, của Dịch vụ y tế Galicia (SERGAS). Chủ đề cụ thể khối lượng 2. Biên tập MAD. Seville-Tây Ban Nha, trang 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Chẩn đoán vi sinh. (Tái bản lần thứ 5). Argentina, Biên tập Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. 2009. Chẩn đoán vi sinh học của Bailey & Scott. 12 ed. Argentina Panamericana S.A Biên tập


