Kinyoun nhuộm nền tảng và kỹ thuật
các Kinyoun nhuộm Đây là một kỹ thuật tạo màu được sử dụng để nhuộm vi khuẩn axit nhanh và ký sinh trùng axit. Nó được sinh ra từ việc sửa đổi màu sắc của Ziehl-Neelsen; Cả hai kỹ thuật được diễn giải theo cùng một cách nhưng chúng khác nhau ở hai yếu tố: trong việc chuẩn bị thuốc thử chính và trong đó kỹ thuật Kinyoun không sử dụng nhiệt.
Vì lý do này, nó còn được gọi là nhuộm lạnh Ziehl-Neelsen hoặc nhuộm lạnh Kinyoun. Nó được chỉ định cho màu của Mycobacterium tuberculosis, Mycobacterium leprae, mycobacteria không điển hình, Nocardias sp, Cryptosporidium parvum, Cryptosporidium meleagridis, Cryptosporidium felis, Cryptosporidium muris và Cyclosporas cayetanensis.
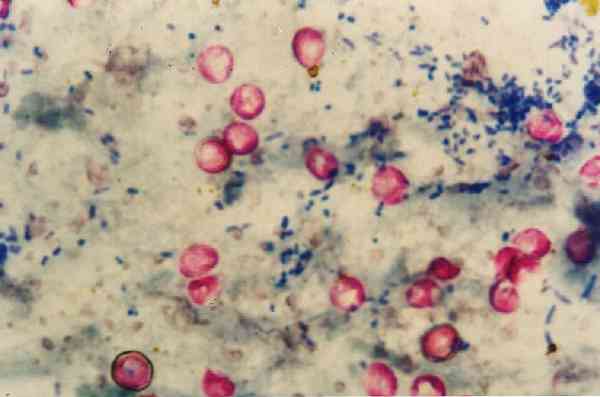
Điều đáng nói là Nocardias nhuộm màu yếu với kỹ thuật này vì chúng là rượu kháng axit một phần, vì vậy đối với thể loại này có sự điều chỉnh về phương pháp.
Đổi lại, kỹ thuật lạnh Kinyoun được kết hợp với kỹ thuật ba màu được sửa đổi bởi Didier để phát hiện ra coccidia (Cryptosporidium parvum e Bánh mì kẹp thịt) và bào tử của microsporidia (Enterocytozoon bieneusi và Encephalitozoon ruột).
Chỉ số
- 1 nền tảng
- 2 Kỹ thuật
- 2.1 Vật liệu
- 2.2 Chuẩn bị Kinyoun fenicated fuchsin
- 2.3 Chuẩn bị axit-rượu
- 2.4 Chuẩn bị thuốc nhuộm tương phản xanh methylen
- 2.5 Kỹ thuật nhuộm Kinyoun
- 2.6 Kỹ thuật Kinyoun đặc biệt cho Nocardias
- 2.7 Kỹ thuật kết hợp giữa fuchsin phenolic và trichromic được sửa đổi bởi Didier
- 2.8 Kiểm soát chất lượng
- Kỹ thuật 3 Kinyoun so với kỹ thuật Ziehl -Neelsen
- 4 Tài liệu tham khảo
Nền tảng
Thuốc thử nhuộm chính là carbol fuchsin hoặc fuchsin fenicada, có đặc tính liên kết với axit carbolic tồn tại trong thành tế bào sáp, giàu lipit (axit mycolic) của mycobacteria và một số ký sinh trùng nhất định..
Sự kết hợp đó không bị phản tác dụng bởi sự khử màu axit; do đó, vi sinh vật được định nghĩa là rượu kháng axit.
Không giống như kỹ thuật Ziehl-Neelsen - cố định thuốc nhuộm bằng nhiệt - trong kỹ thuật Kinyoun, bước này không cần thiết, vì dung dịch phenolic fuchsin được chuẩn bị cho kỹ thuật này có chứa nồng độ phenol cao..
Phenol hòa tan vật liệu lipid của thành tế bào, cho phép sự xâm nhập của thuốc nhuộm carbol fuchsin. Sau khi thuốc nhuộm thâm nhập, nó vẫn cố định mặc dù rửa bằng axit-axit.
Theo cách này, các vi sinh vật kháng axit có màu đỏ đặc trưng, trong khi mọi thứ không phải là cồn kháng axit sẽ bị đổi màu và nhuộm màu xanh lam..
Kỹ thuật
Vật liệu
- Fuchsin biến đổi phenolic.
- Rượu-axit.
- Xanh methylen.
Chuẩn bị Kinyoun fenicated fuchsin
- Fuchsin cơ bản: 4 gr.
- Phenol: 8 ml.
- Rượu (95%): 20 ml.
- Nước cất: 100 ml.
Fuchsin cơ bản trong rượu phải được hòa tan chậm, trộn liên tục. Sau đó, phenol kết tinh được nấu chảy trong bể nước ở 56 ° C. Sau khi hòa tan, thêm 8 ml vào dung dịch fuchsin đã chuẩn bị ở trên.
Chuẩn bị axit-rượu
- Axit clohydric đậm đặc: 3 ml.
- Ethanol (95%): 97 ml.
Nó phải được đo, nối và trộn.
Chuẩn bị thuốc nhuộm tương phản xanh methylen
- Xanh methylen: 0,3 g.
- Nước cất: 100 ml.
Nó được cân và hòa tan.
Kỹ thuật nhuộm Kinyoun
1- Chuẩn bị một vết bẩn trực tiếp từ mẫu, có thể là đờm, dịch phổi, cặn nước tiểu, dịch não tủy hoặc phân, trong số những người khác; hoặc từ việc đình chỉ các vi sinh vật thu được từ các khuẩn lạc tinh khiết được phát triển trong môi trường nuôi cấy sơ cấp.
2- Khắc phục vết bẩn bằng nhiệt.
3- Đặt phết lên cầu màu và phủ thuốc thử phenolic fuchsin của Kinyoun đã chuẩn bị. Hãy để nó ngồi trong 3 hoặc 5 phút.
4 - Rửa bằng nước cất.
5- Tẩy trắng bằng cồn axit trong 3 phút và rửa lại bằng nước cất.
6- Tẩy trắng lại bằng cồn axit trong 1 hoặc 2 phút cho đến khi không còn thuốc nhuộm nào được kéo.
7- Rửa bằng nước cất và để ráo nước, đặt cầu trượt ở vị trí thẳng đứng.
8- Đậy nắp chế phẩm bằng xanh methylen và để trong 4 phút.
9- Rửa bằng nước cất và để khô.
10- Kiểm tra ở 40X và sau đó ở 100X.
Nếu bạn muốn cải thiện và đẩy nhanh quá trình nhuộm vi sinh vật nhanh axit, hãy thêm 1 giọt chất làm ướt (như tergitol số 7) vào 30 hoặc 40 ml fuchsin phenolic của Kinyoun..
Một số phòng thí nghiệm thay đổi thuốc nhuộm tương phản xanh methylen thành axit màu xanh lá cây hoặc picric sáng; cái đầu tiên cho màu xanh lục vào nền và cái thứ hai tạo ra màu vàng.
Kỹ thuật Kinyoun đặc biệt cho Nocardias
Để cải thiện việc nhuộm vi khuẩn Nocardia, một sự điều chỉnh của nhuộm Kinyoun được sử dụng. Kỹ thuật như sau:
1- Che vết bẩn bằng Kinyoun fenicated fuchsin trong 3 phút.
2- Rửa bằng nước cất.
3- Tẩy trắng bằng cồn axit đã chuẩn bị 3% cho đến khi không còn thuốc nhuộm nữa.
4 - Rửa lại bằng nước cất.
5- Đậy nắp chế phẩm bằng xanh methylen và để trong 30 giây.
6- Rửa bằng nước cất và để khô.
Kỹ thuật kết hợp của fuchsin phenolic và trichromic được sửa đổi bởi Didier
Kỹ thuật này được khuyến nghị để phân tích mẫu phân tìm kiếm coccidia và bào tử của Microsporidium sp cùng một lúc Thủ tục cần tuân thủ như sau:
1- Che vết bẩn bằng Kinyoun phenolic fuchsin trong 10 phút.
2- Loại bỏ thuốc nhuộm và rửa bằng nước cất.
3- Tẩy trắng trong 30 giây bằng axit clohydric.
4 - Rửa lại bằng nước cất.
5- Đậy vết bẩn bằng dung dịch ba màu trong 30 phút ở 37 ° C.
6- Rửa bằng nước cất.
7- Giảm màu trong 10 giây bằng axit axetic.
8- Rửa vết bẩn trong 30 giây bằng ethanol 95%.
Kiểm soát chất lượng
Như một sự kiểm soát tích cực, phết tế bào được chuẩn bị với các chủng Mycobacterium tuberculosis và nhuộm màu với các thuốc thử đã chuẩn bị để xác minh rằng vi khuẩn có màu đúng (đỏ-fuchsia).
Các biện pháp kiểm soát tiêu cực cũng có thể được sử dụng bằng cách chuẩn bị các vết bẩn với bất kỳ chủng nào không phải là rượu kháng axit, do đó xác minh rằng toàn bộ mẫu có màu tương phản.
Kỹ thuật Kinyoun so với kỹ thuật Ziehl -Neelsen
Kỹ thuật Kinyoun đơn giản hơn vì nó giúp loại bỏ bước sưởi ấm, nhưng ưu điểm chính của nó là ngăn chặn sự phát thải của hơi, độc tính cao và gây ung thư trong thời gian dài. Do đó, nhuộm Kinyoun an toàn hơn cho nhân viên nhuộm màu.
Điều quan trọng là phải tính đến việc cần phải chú ý rằng các thuốc thử không tiếp xúc trực tiếp với da, vì chúng bị ăn mòn và chất tẩy là dễ cháy.
Về những nhược điểm, một vết bẩn âm tính không nhất thiết chỉ ra rằng vi sinh vật không có mặt. Ngoài ra, sự hiện diện của mảnh vụn tế bào có thể gây ra dương tính giả, gây nhầm lẫn trong chẩn đoán.
Tham khảo
- Ứng dụng hóa học lâm sàng (2016). Bộ BK Kinyoun. Có sẵn tại: cromakit.es
- Orozco-Rico Miguel. Vết Kinyoun và hai con Coccidia trong HIV. Tạp chí y khoa MD. 2011; 3 (2): 137
- Forbes B, Sahm D, Weissfeld A (2009). Chẩn đoán vi sinh của Bailey & Scott. 12 ed. Argentina Panamericana S.A Biên tập.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Chẩn đoán vi sinh. (Tái bản lần thứ 5). Argentina, Biên tập Panamericana S.A..
- Wikipedia đóng góp. "Vết Kinyoun." Wikipedia, bách khoa toàn thư miễn phí. Wikipedia, Bách khoa toàn thư miễn phí, ngày 8 tháng 2 năm 2018. Web. Ngày 5 tháng 1 năm 2019.
- Combol A, Fernández N, Figueredo E, Acuña A, Zanetta E. Thực hiện kỹ thuật tạo màu để chẩn đoán đồng thời Coccidia và microsporidia. Viện Vệ sinh của Đại học Cộng hòa. Sê-ri. Uruguay Có sẵn tại: higiene.edu.uy


