Ethyl ether tính chất, cấu trúc, thu được, sử dụng
các etyl ete, còn được gọi là dietyl ete, là một hợp chất hữu cơ có công thức hóa học là C4H10O. Nó được đặc trưng bởi là một chất lỏng không màu và dễ bay hơi, và do đó, các chai của nó phải được giữ kín càng tốt càng tốt.
Ether này được phân loại là một thành viên của ete dialkyl; nghĩa là, chúng có công thức ROR ', trong đó R và R' đại diện cho các phân đoạn carbon khác nhau. Và như nó mô tả tên đệm của nó, dietyl ete, là hai gốc - ethyl liên kết với nguyên tử oxy.

Ban đầu ethyl ether được sử dụng làm thuốc gây mê nói chung, được giới thiệu vào năm 1846 bởi William Thomas Green Morton. Tuy nhiên, do tính dễ cháy của nó, việc sử dụng nó đã bị từ chối, thay thế bằng thuốc gây mê ít nguy hiểm khác..
Hợp chất này cũng đã được sử dụng để ước tính thời gian lưu thông máu, trong quá trình đánh giá tình trạng tim mạch của bệnh nhân.
Trong cơ thể, dietyl ete có thể được chuyển hóa thành carbon dioxide và các chất chuyển hóa; cuối cùng được bài tiết qua nước tiểu. Tuy nhiên, hầu hết ether được quản lý được thở ra trong phổi, mà không trải qua bất kỳ sửa đổi nào.
Mặt khác, nó được sử dụng làm dung môi cho xà phòng, dầu, nước hoa, ancaloit và nướu.
Chỉ số
- 1 Cấu trúc của etyl ete
- 1.1 Các lực liên phân tử
- 2 Tính chất lý hóa
- 2.1 Tên khác
- 2.2 Công thức phân tử
- 2.3 Trọng lượng phân tử
- 2.4 Ngoại hình
- Mùi 2,5
- 2.6 Hương vị
- 2.7 Điểm sôi
- 2.8 Điểm nóng chảy
- 2.9 Điểm chớp cháy
- 2.10 Độ hòa tan trong nước
- 2.11 Độ hòa tan trong các chất lỏng khác
- Mật độ 2,12
- 2.13 Mật độ hơi
- 2.14 Áp suất hơi
- Ổn định 2,15
- 2.16 Đánh lửa tự động
- Phân tích 2,17
- 2,18 Độ nhớt
- 2.19 Nhiệt đốt cháy
- 2.20 Nhiệt hóa hơi
- 2.21 Sức căng bề mặt
- 2.22 Tiềm năng ion hóa
- 2.23 Ngưỡng mùi
- 2,24 chiết suất
- 3 Lấy
- 3.1 Từ rượu etylic
- 3.2 Từ etylen
- 4 Độc tính
- 5 công dụng
- 5.1 Dung môi hữu cơ
- 5.2 Gây mê toàn thân
- 5.3 Tinh thần của ether
- 5.4 Đánh giá lưu thông máu
- 5.5 Phòng thí nghiệm giảng dạy
- 6 tài liệu tham khảo
Cấu trúc của etyl ete
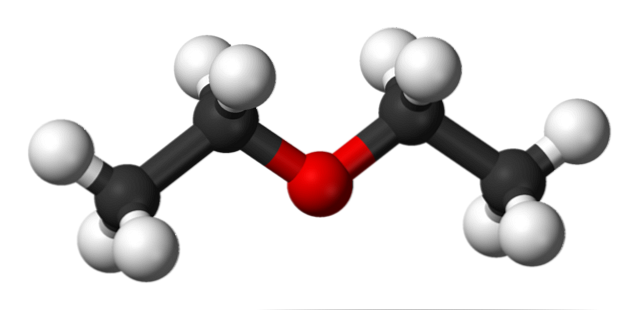
Trong hình trên, chúng ta có một mô hình với các hình cầu và thanh của cấu trúc phân tử của ethyl ether.
Có thể thấy, quả cầu đỏ, tương ứng với nguyên tử oxy, có hai nhóm ethyl được liên kết ở cả hai phía. Tất cả các liên kết đều đơn giản, linh hoạt và có thể xoay tự do quanh các trục.
Các phép quay này bắt nguồn từ các đồng phân lập thể được gọi là tuân thủ; rằng nhiều hơn các đồng phân, chúng là các trạng thái không gian thay thế. Cấu trúc của hình ảnh tương ứng chính xác với chất chống tuân thủ, trong đó tất cả các nhóm nguyên tử của nó được đặt so le (tách biệt với nhau).
Điều gì sẽ là phù hợp khác? Bị lu mờ và mặc dù hình ảnh của bạn không có sẵn, chỉ cần hình dung nó với hình chữ U. Ở đầu trên của chữ U sẽ được đặt các nhóm methyl, -CH3, sẽ gặp phải lực đẩy không gian (chúng sẽ va chạm trong không gian).
Do đó, người ta hy vọng rằng phân tử CH3CH2OCH2CH3 áp dụng các hình thức chống hầu hết thời gian.
Lực liên phân tử
Những lực liên phân tử nào là các phân tử của etyl ete chi phối trong pha lỏng? Chúng được duy trì trong chất lỏng chủ yếu nhờ các lực phân tán, vì mômen lưỡng cực của chúng (1,5D) thiếu một vùng thiếu mật độ điện tử (δ +)
Điều này là do không có nguyên tử carbon của các nhóm ethyl cung cấp quá nhiều mật độ electron cho nguyên tử oxy. Trên đây là rõ ràng với bản đồ tiềm năng tĩnh điện của ethyl ether trong tay (hình dưới). Lưu ý sự vắng mặt của một vùng màu xanh.
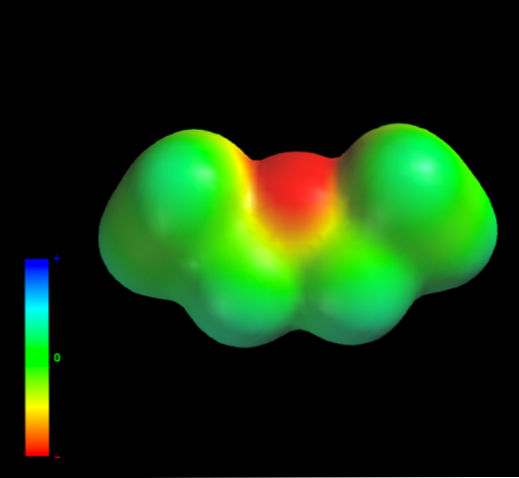
Oxy cũng không thể hình thành liên kết hydro, bởi vì không có liên kết O-H có sẵn trong cấu trúc phân tử. Do đó, chính các lưỡng cực tức thời và khối lượng phân tử của chúng có lợi cho lực phân tán của chúng.
Mặc dù vậy, nó hòa tan cao trong nước. Tại sao? Bởi vì nguyên tử oxy của nó, với mật độ electron cao hơn, có thể chấp nhận các liên kết hydro từ một phân tử nước:
(CH3CH2)2Ôiδ- - δ+H-OH
Các tương tác này chịu trách nhiệm cho 6.04g ether này hòa tan trong 100mL nước.
Tính chất hóa lý
Tên khác
-Dietyl ete
-Ethoxyethane
-Ôxít etyl
Công thức phân tử
C4H10O hoặc (C2H5)2Ôi.
Trọng lượng phân tử
74,14 g / mol.
Ngoại hình
Chất lỏng không màu.
Mùi
Ngọt và cay.
Hương vị
Đốt cháy và ngọt ngào.
Điểm sôi
94,3 FF (34,6 CC) đến 760 mmHg.
Điểm nóng chảy
-177,3 FF (-116,3 CC). Tinh thể ổn định.
Điểm đánh lửa
-49ºF (thùng kín).
Độ hòa tan trong nước
6.04 g / 100mL ở 25 ºC.
Độ hòa tan trong các chất lỏng khác
Có thể trộn với rượu aliphatic chuỗi ngắn, benzen, cloroform, ete dầu mỏ, dung môi chất béo, nhiều loại dầu và axit clohydric đậm đặc.
Hòa tan trong acetone và rất hòa tan trong ethanol. Nó cũng hòa tan trong naphta, benzen và dầu.
Mật độ
0,714 mg / mL ở 68 F (20 ºC).
Mật độ hơi
2,55 (liên quan đến không khí lấy với mật độ 1).
Áp suất hơi
438 mmHg ở 68 FF. 538 mmHg ở 25 ° C. 58,6 kPa ở 20 ºC.
Ổn định
Nó bị oxy hóa chậm bởi tác động của không khí, độ ẩm và ánh sáng với sự hình thành của peroxit.
Sự hình thành của peroxit có thể xảy ra trong các thùng chứa ether đã được mở và lưu giữ trong hơn sáu tháng. Peroxit có thể phát nổ do ma sát, va đập hoặc sưởi ấm.
Tránh tiếp xúc với: kẽm, halogen, oxyhalide phi kim loại, chất oxy hóa mạnh, chromyl clorua, dầu tementin, nitrat và clorua kim loại.
Tự động đánh lửa
356ºF (180 CC).
Phân hủy
Khi nóng lên, nó bị phân hủy, phát ra khói cay và khó chịu.
Độ nhớt
0,2448 cP rùa ở 20 ºC.
Nhiệt lượng đốt cháy
8,807 Kcal / g.
Nhiệt bay hơi
89,8 cal / g ở 30 ºC.
Sức căng bề mặt
17,06 dynes / cm ở 20 độ C.
Tiềm năng ion hóa
9,53 eV.
Ngưỡng mùi
0,83 ppm (độ tinh khiết không được cung cấp).
Chỉ số khúc xạ
1.355 ở 15 ºC.
Lấy
Từ rượu etylic
Ethyl ether có thể thu được từ rượu ethyl, với sự có mặt của axit sulfuric làm chất xúc tác. Axit sulfuric trong môi trường nước phân ly tạo ra ion hydronium, H3Ôi+.
Rượu ethyl khan chảy qua dung dịch axit sunfuric, được làm nóng trong khoảng từ 130 ° C đến 140 ° C, tạo ra sự proton hóa của các phân tử rượu ethyl. Sau đó, một phân tử khác của rượu ethyl không proton phản ứng với phân tử proton.
Khi điều này xảy ra, cuộc tấn công nucleophin của phân tử rượu ethyl thứ hai thúc đẩy sự giải phóng nước từ phân tử thứ nhất (phân tử proton); kết quả là một etyl ete được proton hóa được hình thành (CH3CH2OHCH2CH3), với oxy dương tính một phần.
Tuy nhiên, phương pháp tổng hợp này làm mất hiệu quả vì axit sunfuric được pha loãng với nước được sản xuất trong quá trình (sản phẩm khử nước của rượu etylic).
Nhiệt độ của phản ứng là rất quan trọng. Ở nhiệt độ dưới 130 ° C, phản ứng chậm và phần lớn rượu ethyl sẽ được chưng cất.
Trên 150 ° C, axit sulfuric gây ra sự hình thành ethylene (anken liên kết đôi), thay vì kết hợp với rượu ethyl để tạo thành ethyl ether.
Từ etylen
Trong quá trình ngược lại, đó là sự hydrat hóa ethylene trong pha hơi, ethyl ether có thể được tạo thành như một sản phẩm phụ ngoài rượu ethyl. Trên thực tế, tuyến đường tổng hợp này tạo ra hầu hết các hợp chất hữu cơ này.
Quá trình này sử dụng các chất xúc tác axit photphoric cố định vào một giá đỡ vững chắc, có thể điều chỉnh để tạo ra nhiều ether hơn.
Sự mất nước trong pha hơi của ethanol với sự có mặt của chất xúc tác alumina, có thể cho năng suất 95% trong sản xuất ethyl ether.
Độc tính
Nó có thể tạo ra kích ứng trên da và mắt khi tiếp xúc. Sự tiếp xúc với da có thể gây khô và nứt nẻ. Ether không thường xuyên xâm nhập vào da, vì nó nhanh chóng bị bay hơi.
Kích ứng mắt do ether gây ra thường nhẹ và trong trường hợp kích ứng nghiêm trọng, tổn thương thường hồi phục.
Ăn vào của nó tạo ra hiệu ứng ma túy và kích thích dạ dày. Ăn uống nghiêm trọng có thể gây tổn thương thận.
Hít phải ether có thể gây kích ứng mũi và cổ họng. Trong trường hợp hít phải ether có thể xảy ra: buồn ngủ, hưng phấn, chóng mặt, nôn, thở không đều và tăng tiết nước bọt.
Phơi nhiễm cao có thể gây mất ý thức và thậm chí tử vong.
OSHA thiết lập giới hạn phơi nhiễm nghề nghiệp trung bình 800 ppm trong ca làm việc 8 giờ.
Mức độ kích ứng mắt: 100 ppm (người). Mức độ kích ứng mắt: 1200 mg / m3 (400 ppm).
Công dụng
Dung môi hữu cơ
Nó là một dung môi hữu cơ được sử dụng để hòa tan brom, iốt và các halogen khác; phần lớn lipit (chất béo), nhựa, cao su nguyên chất, một số alcaloid, nướu, nước hoa, cellulose acetate, cellulose nitrate, hydrocarbon và thuốc nhuộm.
Ngoài ra, nó được sử dụng trong việc chiết xuất các nguyên tắc hoạt động của mô và thực vật, bởi vì nó có mật độ thấp hơn nước và nổi trên đó, để lại các chất mong muốn hòa tan trong ether.
Gây mê toàn thân
Nó đã được sử dụng làm thuốc gây mê nói chung từ năm 1840, thay thế chloroform để có lợi thế trị liệu. Tuy nhiên, nó là một chất dễ cháy, và do đó, gặp phải những khó khăn nghiêm trọng khi sử dụng nó trong môi trường lâm sàng.
Ngoài ra, nó tạo ra ở bệnh nhân một số tác dụng phụ không mong muốn sau phẫu thuật như buồn nôn và nôn.
Vì những lý do này, việc sử dụng ether làm thuốc gây mê nói chung đã bị loại bỏ, thay thế nó bằng thuốc gây mê khác như halothane..
Tinh thần của ether
Ether trộn với ethanol đã được sử dụng để tạo thành dung dịch gọi là tinh thần của ether, được sử dụng trong điều trị đầy hơi dạ dày và các dạng nhẹ hơn của dạ dày.
Đánh giá lưu thông máu
Ether đã được sử dụng để đánh giá lưu thông máu giữa một cánh tay và phổi. Ether được tiêm vào một cánh tay, đưa máu đến tâm nhĩ phải, sau đó đến tâm thất phải và từ đó đến phổi.
Thời gian trôi qua từ khi bơm ether, đến khi hấp thụ mùi ether trong không khí thở ra, là khoảng 4 đến 6 giây.
Phòng thí nghiệm giảng dạy
Ether được sử dụng trong các phòng thí nghiệm giảng dạy trong nhiều thí nghiệm; ví dụ, trong việc chứng minh quy luật di truyền của Mendel.
Ether được sử dụng để làm tê liệt ruồi thuộc chi Drosophila và cho phép sự giao thoa cần thiết giữa chúng, để đưa ra bằng chứng về quy luật di truyền
Tài liệu tham khảo
- Graham Solomons T.W., Craig B. Fryhle. (2011). Hóa hữu cơ. Amin (10thứ phiên bản.). Wiley Plus.
- Carey F. (2008). Hóa hữu cơ (Ấn bản thứ sáu). Đồi Mc Graw.
- Các Sevier. (2018). Dietyl ete. Khoa học trực tiếp. Lấy từ: scTHERirect.com
- Các biên tập viên của bách khoa toàn thư Britannica. (2018). Ethyl ete. Britannica ncyclopædia. Lấy từ: britannica.com
- PubChem (2018). Ether. Lấy từ: pubool.ncbi.nlm.nih.gov
- Wikipedia. (2018). Dietyl ete. Lấy từ: en.wikipedia.org
- Bảng an toàn XI: etyl ete. [PDF] Phục hồi từ: quimica.unam.mx


